El Grupo de Investigación en Virología Molecular del Departamento de Medicina y Ciencias de la Vida, Universidad Pompeu Fabra (MELIS-UPF), dirigido por Juana Diez, y el grupo de Epitranscriptoma y dinámica de ARN del Centro de Regulación Genómica (CRG), dirigido por Eva M. Novoa, han liderado un estudio sobre cómo los virus reprograman la maquinaria celular huésped en su beneficio para así reproducirse de forma más eficiente.
En concreto, los equipos científicos han observado que la infección viral induce una reprogramación de las modificaciones de los ARNt celulares para favorecer la traducción de los codones virales. Así, maximizan la expresión de sus proteínas y, por tanto, la infección viral.
La paradoja de la eficiente traducción viral
Los virus dependen completamente de la maquinaria de traducción de la célula huésped. Para expresar las proteínas virales a partir de su material genético, los virus necesitan los ARNt (ARN de transferencia) de la célula. Éstos detectan los codones del ARN viral que determinan uno u otro aminoácido.
El código genético, que establece a qué aminoácido corresponde cada codón, es redundante, lo que permite que un aminoácido esté codificado por más de un codón. La frecuencia de estos codones sinónimos no es aleatoria, sino que está sesgada y es específica de cada organismo. Como la concentración de los ARNt en cada organismo está adaptada a esta frecuencia, los codones sub-óptimos ralentizan la traducción porque los ARNt correspondientes son poco abundantes en comparación con los ARNt que reconocen los codones óptimos.
La dependencia viral de los ARNt celulares es especialmente crítica para los virus RNA de cadena positiva (RNA+) cuyo primer paso en el ciclo de infección es precisamente la traducción del RNA viral. El grupo de virus RNA+ incluye muchos virus patógenos humanos, incluyendo virus nuevos y emergentes tales como el SARS CoV-2 o los virus transmitidos por mosquitos dengue, zika o chikunguña.
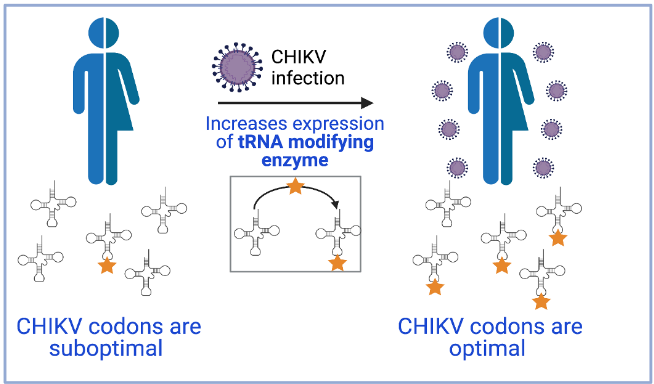
Todos estos virus expresan sus proteínas a niveles altísimos. Sin embargo, los genomas de estos virus están enriquecidos en codones subóptimos y, por tanto, deberían traducirse ineficientemente. Para resolver esta paradoja los autores usaron como modelo de estudio el virus chikunguña por su alto nivel de replicación.
El secreto está en el epitranscriptoma
El trabajo del MELIS-UPF y el CRG, que ha contado también con la colaboración de investigadores de la Universidad de Tartu, ha observado que la infección por el virus del chikunguña induce un estrés celular que lleva a un aumento de la producción de la enzima de modificación del ARNt KIAA1456. Esto conlleva cambios en el epitranscriptoma (el conjunto de modificaciones químicas que sufre el ARN) que favorecen el reconocimiento por parte de los ARNt celulares de codones subóptimos, presentes en proteínas celulares de respuesta a estrés y también en el virus, que pasan así a ser óptimos. Por tanto, el genoma del virus chikunguña ha evolucionado para que la composición de sus codones sea óptima en las condiciones de infección de la célula hospedadora.
“Aunque el estudio se ha centrado en el virus del chikunguña, hemos confirmado que otros virus utilizan una estrategia similar para favorecer la expresión de sus proteínas por lo que proponemos que la modificación de los ARNt inducidos por la infección viral es un mecanismo general seguido por muchos virus”
Juana Díez, jefa del grupo del MELIS-UPF e investigadora principal del estudio
Los experimentos se han realizado con líneas celulares ya establecidas de células humanas del hígado, células renales embrionarias y fibroblastos de riñón. El descubrimiento pone a las enzimas de modificación del ARNt en el punto de mira a la hora de estudiar otros virus y nuevas dianas terapéuticas para el desarrollo de antivirales de amplio espectro.
Jungfleisch J et al. CHIKV infection reprograms codon optimality to favor viral RNA translation by altering the tRNA epitranscriptome. Nature Communications. August, 2022. DOI: 10.1038/s41467-022-31835-x.