Estamos en contacto constante con bacterias, virus y hongos. De hecho, hay algunos que conviven con nosotros formando parte de nuestra microbiota o microbioma. Sin embargo no todos los microorganismos son inocuos; también hay microorganismos patógenos que causan enfermedades e infecciones. Cuando alguno de estos microbios entra en nuestro organismo, provoca la activación de procesos complejos que nos ayudan a combatir la infección.
Defensa y ataque. Un drama de acción en tres actos.
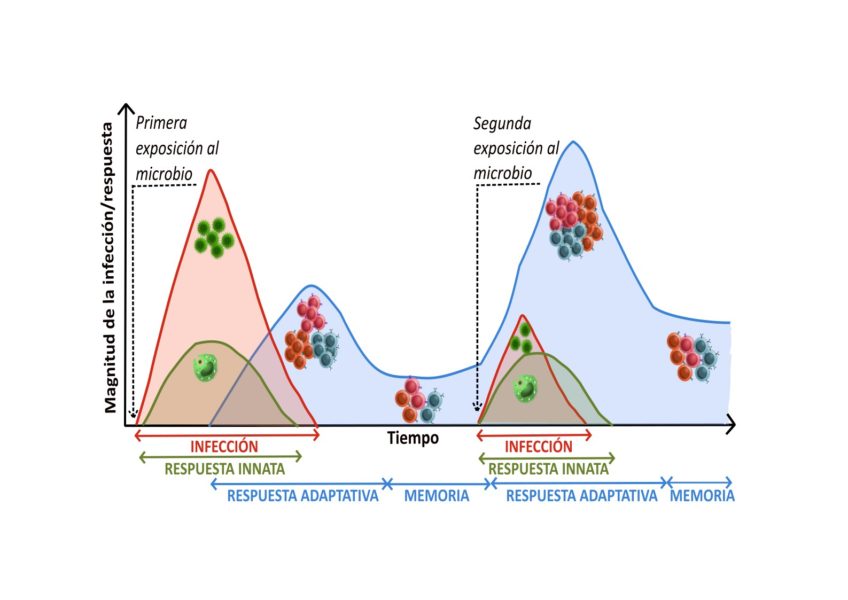
Desde el momento en que un microorganismo infeccioso entra en nuestro cuerpo, se activan mecanismos destinados a eliminarlo. Para conseguirlo necesitamos:
- Un sistema que ayude a frenar la infección en las etapas iniciales
- Un sistema que erradique la infección por completo
- Memoria para recordar qué microbio nos ha infectado y poder combatirlo más rápidamente en el futuro
Acto I: Rapidez para frenar la infección
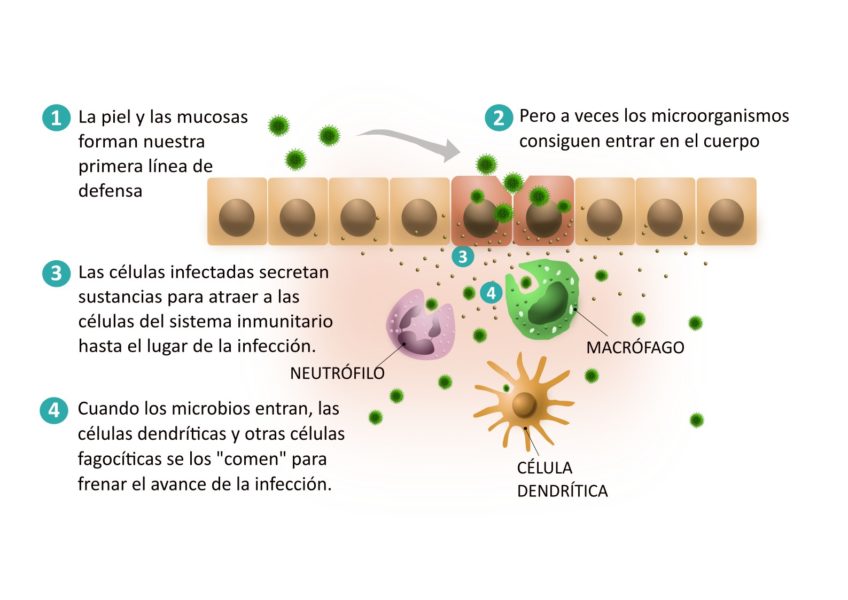
La primera defensa que interviene se conoce con el nombre de sistema immunitario innato. La piel, junto con las mucosas y las membranas que recubren los tractos digestivo, respiratorio y genitourinario, forman nuestra primera línea de defensa. Además, secreciones como la saliva, las lágrimas y el mucus contienen sustancias que destruyen los microorganismos.
Sin embargo, a veces los patógenos consiguen superar estas barreras físicas y químicas y entran en el cuerpo. En este momento, se activan otros componentes del sistema inmunitario que nos ayudarán a combatir la infección. Pero, ¿cómo lo hacen?
En primer lugar, la célula infectada empieza a secretar unas sustancias llamadas interferones, que protegen las células de alrededor de ser infectadas. De este modo las intenta proteger para que la infección no se disemine. A su vez, estas sustancias también hacen “efecto llamada” para que las células del sistema inmunitario acudan al lugar de la infección.
En las capas internas de la piel y las mucosas encontramos las primeras células inmunitarias que intentarán contener la infección; allí encontramos células dendríticas y otras células fagocíticas. Estas células reconocen estructuras y proteínas que se encuentran en bacterias, virus y hongos pero no en las células de nuestro cuerpo. Esto les permite dar una respuesta rápida e inespecífica, es decir, que actúan del mismo modo frente a todo tipo de patógenos, no hacen distinciones. De este modo se puede contener la infección de microorganismos muy diversos. Esta respuesta se da durante los primeros días de la infección y ayuda a contenerla, dando tiempo a que se activen otros mecanismos de respuesta más especializados.
Las células dendríticas y otras células fagocíticas que se encuentran en los tejidos infectados son capaces de “comerse” el microbio causante de la infección. Una vez lo han procesado, las células dendríticas viajan hasta los ganglios linfáticos para activar las células que darán una respuesta más específica para erradicar la infección, las células del sistema inmunitario adaptativo.
Acto II. Especificidad para erradicar la infección
Y, ¿cómo se activa el sistema inmunitario adaptativo?
Las células encargadas de dar una respuesta específica son las células B y T (también llamadas linfocitos B y T). Cuando no hay ningún patógeno, circulan por la sangre en forma inactiva. Cada célula B y T tiene un receptor único que se ha formado al azar. Cada receptor puede reconocer una única molécula extraña para el cuerpo, totalmente específica. Estas moléculas extrañas reconocidas por los receptores se llaman antígenos. En ausencia de estos antígenos, las células B y T siguen inactivas.
Cada uno de estos tipos celulares ocupa una zona dentro del ganglio. Cuando la célula dendrítica llega, se encuentra con las células T inactivas. Las células dendríticas digieren los microbios que han comido y enseñan trocitos de proteínas (péptidos) a las células T. Esta presentación se hace a través de unas moléculas denominadas HLA. Cuando una célula T expresa un receptor que reconoce el complejo HLA-péptido: ¡bingo! La célula con el receptor “ganador” inicia una expansión clonal, es decir, empieza a activarse, a dividirse y forma un clon de linfocitos T efectores. A diferencia de los linfocitos T inactivos, los efectores son capaces de activarse por contribuir a la defensa frente a la infección.
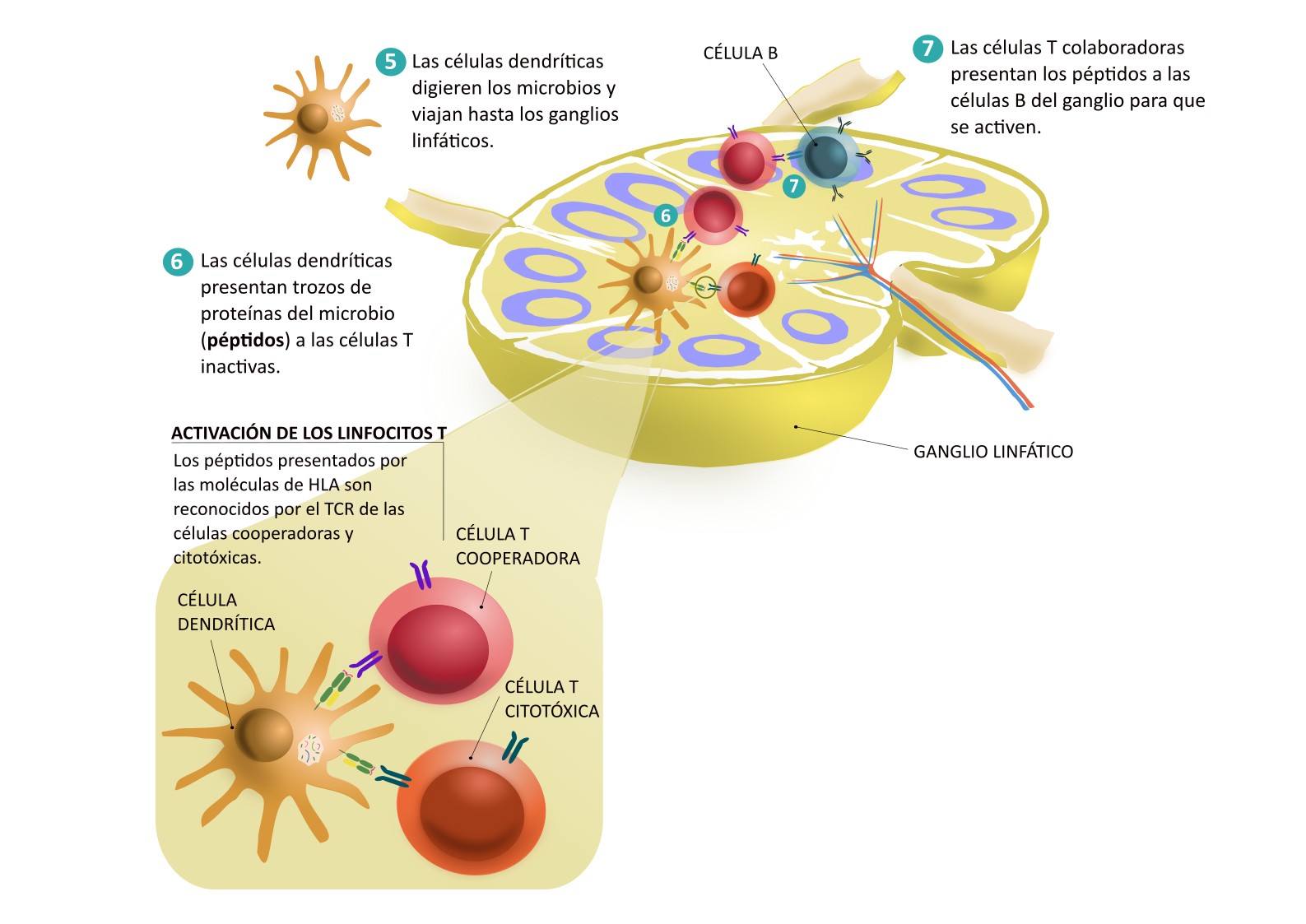
Hay dos clases de linfocitos T efectores: los citotóxicos y los cooperadores:
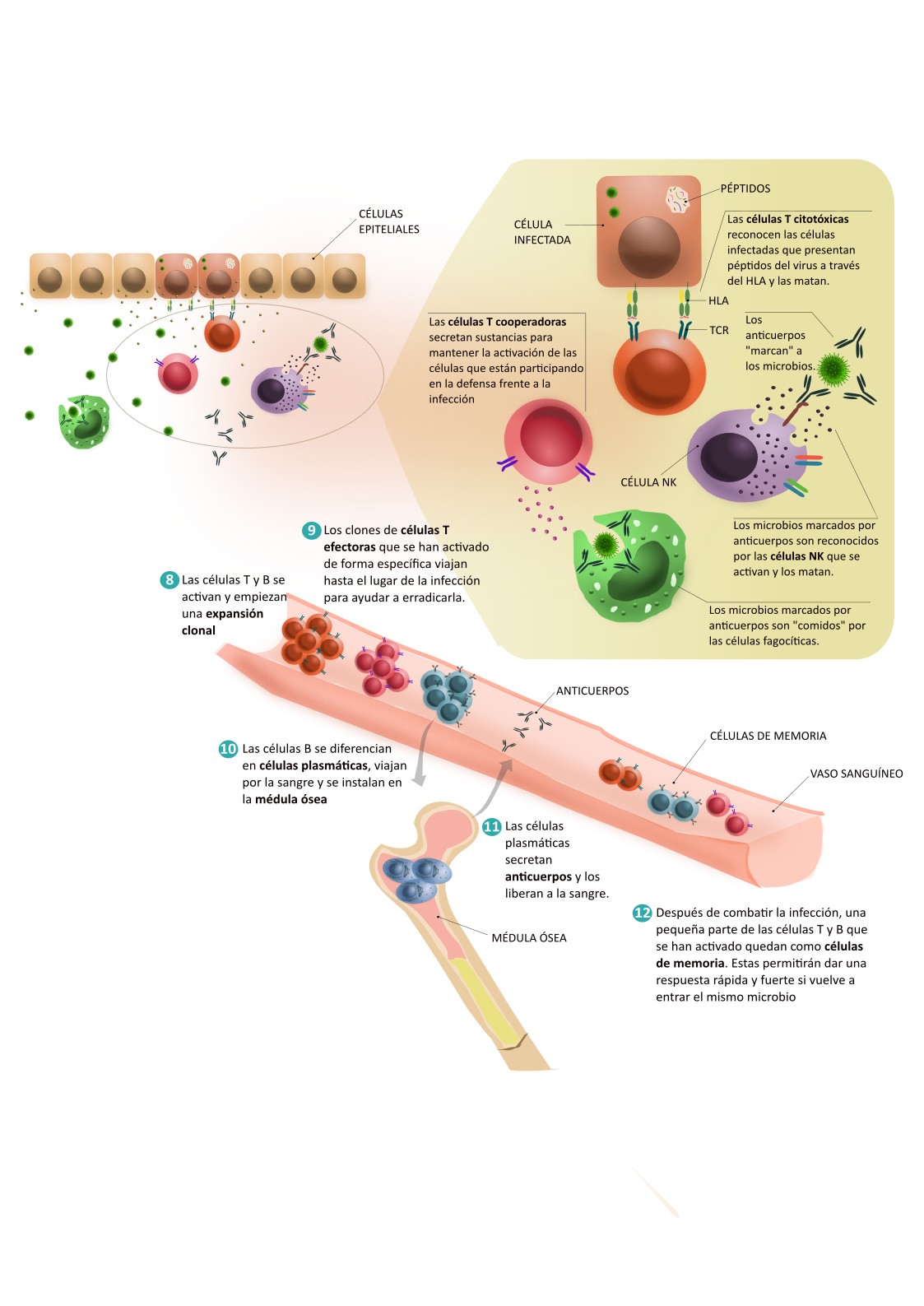
- Los linfocitos T citotóxicos salen de los ganglios linfáticos y viajan a través de la sangre hasta el tejido infectado. Cuando llegan, reciben señales que los hacen salir de los vasos sanguíneos para entrar en el tejido. Allí se encuentran con las células infectadas que están presentando péptidos del microbio a través del HLA, de la misma forma que lo hacían las células dendríticas. Los linfocitos T citotóxicos son capaces de reconocer esos péptidos y matar a la célula que los presenta.
- Los linfocitos T cooperadores, que también se activan en los ganglios, producen sustancias que ayudan a mantener la activación de las células implicadas en la defensa frente a la infección. Entre otras funciones, las T cooperadoras también ayudan a activar a los linfocitos B de los ganglios.
Hemos visto cómo se activan y actúan las células T, pero, ¿qué pasa con las B? Las células B se activan gracias a la ayuda de las células T cooperadoras del ganglio. La activación de las células B provoca su diferenciación en células plasmáticas. Algunas de estas células viajan por la sangre hasta la médula ósea, lugar donde se quedan a “vivir”. Desde allí producen anticuerpos que contribuirán a protegernos. Nos protegen de distintas formas, entre ellas:
- Bloquean la entrada de microbios a las células
- “Marcan” a los microbios para que sean comidos por las células del sistema innato.
- “Marcan” a las células infectadas para que sean eliminadas por las células NK, unas células del sistema inmunitario innato capaces de reconocer anticuerpos.
Las células plasmáticas pueden seguir produciendo anticuerpos incluso décadas después de haber estado expuestas al microbio. Pasada la infección, los siguen secretando en cantidades bajas y ayudan a que estemos preparados para una nueva entrada del mismo microorganismo.
Acto III. Memoria para recordar la infección
Después de combatir la infección, una pequeña parte de las células T y B específicas que se han generado, quedan como células de memoria. Las células de memoria quedarán circulando por la sangre y mantendrán su capacidad de reconocer el antígeno para el que han sido seleccionadas. Por lo tanto, si detectan de nuevo células infectadas por el mismo microorganismo, estarán preparadas para activarse, dividirse y llevar a cabo su función de forma inmediata. Eso permite dar una respuesta mucho más rápida y fuerte cuando volvemos a estar en contacto con el mismo patógeno.
Las vacunas permiten generar células de memoria antes de ser infectados por el microbio. Se utilizan fragmentos de patógenos, patógenos inactivados y otro tipo de recursos para estimular el sistema inmunitario a simular la respuesta que daría frente a la infección real. De este modo se consigue generar memoria inmunitaria para poder responder rápidamente en caso de entrada del patógeno real al organismo.
El contraataque de los microbios
¡Pero mientras nuestro cuerpo se intenta defender, los microorganismos no se quedan de brazos cruzados! Para cada tipo de infección hay una respuesta inmunitaria que evolutivamente se ha adaptado a las particularidades de cada tipo de microbio. A su vez, han sobrevivido los patógenos que han encontrado formas de escapar y evitar la acción del sistema inmunitario. Este es el caso de algunos virus.
Hay virus que han evolucionado para pasar desapercibidos y engañar a nuestras defensas impidiendo que reconozcan las células infectadas. Uno de los mecanismos que utilizan es provocar la disminución de la expresión de moléculas de HLA. Debido a que disminuyen su presencia en la superficie de las células infectadas, esas células no pueden presentar los péptidos del virus. Por lo tanto, los linfocitos T no las reconocen como infectadas y no las pueden eliminar.
¿Entonces, por qué este tipo de virus no son más peligrosos? Porque en nuestro sistema inmunitario tenemos otros mecanismos aparte de los descritos hasta ahora. Por ejemplo, tenemos un tipo de linfocitos que se llaman NK (Natural Killer) que tienen un papel muy importante en la defensa frente a las infecciones virales. Las células NK forman parte de nuestro sistema inmune innato. En condiciones normales, estas células están inhibidas pero cuando detectan que una célula no enseña las moléculas de HLA, secretan unas sustancias que perforan la membrana y la matan. Este es un ejemplo de la complejidad de la respuesta inmunitaria y de cómo se ha adaptado evolutivamente para responder a cada tipo de infección.
El sistema inmunitario y los microorganismos infecciosos han evolucionado conjuntamente. En algunos casos, han llegado a un equilibrio, lo que se conoce como infección latente. El sistema inmunitario controla la infección pero no consigue eliminar el patógeno y a su vez el microbio puede sobrevivir dentro del cuerpo en un estado “dormido”. Este es el caso por ejemplo de la infección por citomegalovirus o la infección causada por la bacteria de la tuberculosis.
Estudiar cómo nos defendemos de los microorganismos infecciosos y a su vez entender cómo reacciona el microbio a nuestro sistema inmunitario es clave para comprender cómo funcionan las infecciones y pensar qué estrategias terapéuticas podemos aplicar para combatirlas. En el grupo de inmunología de la Universidad Pompeu Fabra dirigido por Miguel López-Botet estudiamos los cambios que provoca la infección por citomegalovirus en el conjunto de células NK y células T. También estudiamos qué mecanismos de defensa tienen estos dos grupos de células frente a la infección viral.