L’equip del Centre de Regulació Genòmica (CRG) liderat per Eva Maria Novoa ha publicat recentment una nova metodologia que permet, per primera vegada, quantificar tant els nivells d’ARN de transferència (ARNt) com les seves modificacions de forma ràpida i poc costosa. Això obre la porta a un possible i revolucionari test diagnòstic per al càncer que podria, en menys de 3h i per menys de 50€, indicar qui té càncer i quin tipus, a partir d’una simple mostra de sang.
Detecció del càncer: ADN vs ARN
Fins ara, a part de amb proves d’imatge o altres a nivell clínic, el càncer es podia detectar a partir de l’ADN (seqüenciant les mutacions existents) o de l’ARNm circulant a la sang, alliberat a través del trencament de les cèl·lules tumorals. La seqüenciació de l’ADN es fa de forma rutinària des de fa dècades, amb Illumina sent la tecnologia més utilitzada. Però això “pot costar milers d’euros per cada mostra”, explica Novoa.
La detecció de l’ARN, en canvi, pot ser més informativa i econòmica. Els ARNs de les cèl·lules tumorals també s’alliberen a la sang, i els ARNt són de fet de les molècules de ARN més abundants. A més, al llarg dels anys s’han acumulat prou evidències que les modificacions de l’ARN estan alterades en moltes malalties, en particular en diferents tipus de càncer. Així que saber quins ARNs hi ha a la sang, i amb quines modificacions, podria indicar presència de cèl·lules tumorals, així com de quin teixit provenen. Aquesta és la idea darrera la recerca del grup del CRG.
Els ARNt són les molècules d’ARN més abundants i les seves modificacions estan alterades en moltes malalties, en particular en diferents tipus de càncer, convertint-los en molt bons biomarcadors del càncer.
Modificacions de l’ARN, el quid de la qüestió
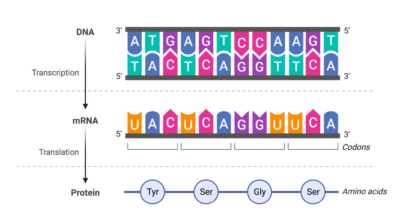
Oxford Nanopore Technologies, una tecnologia alternativa a Illumina, va començar el 2017 a permetre seqüenciar no tan sols ADN, sinó ARN nadiu. “Fins aleshores, per saber la quantitat d’ARN amb Illumina, havies de fer una transcripció reversa (passar d’ARN a ADN complementari), amplificar-lo i seqüenciar-lo. Però un greu problema és que la transcripció reversa ‘esborra’ les modificacions de l’ARN… per tant només pots saber-ne l’abundància, però no les modificacions. Es perd molta informació, informació important”, assegura Novoa.
Amb Illumina també es poden arribar a estudiar modificacions de l’ARN, a través d’anticossos específics contra una modificació concreta cada vegada, però és de forma indirecta i predeterminada, i sense resolució a nivell de molècula. I amb els ARNs que tenen moltes modificacions (com els ribosomals (ARNr), o els de transferència (ARNt), que poden tenir unes 30 modificacions per molècula de mitjana) és quasi impossible convertir-los en ADN per a ser seqüenciats per Illumina.
L’arribada de la tecnologia Nanopore va fer possible seqüenciar no tan sols l’ADN sinó els ARNs amb les seves modificacions, fent ‘una fotografia’ més detallada de la informació genètica de la cèl·lula.
En canvi, Nanopore permet fer ‘una fotografia’ dels ARNs de la mostra tal qual, amb les seves modificacions – i de tots a la vegada. La tecnologia consisteix en un petit aparell que cap a la mà, d’uns 10 cm de longitud, que conté dins unes membranes amb nanopors o canals per on passen les molècules d’ARN o ADN. En travessar els pors, n’alteren la corrent elèctrica i l’aparell llegeix aquest canvi de corrent i en dedueix la seqüència i les modificacions. Encara cal certa preparació (“cal afegir un adaptador als ARNs per a fer que passin pels nanopors a una velocitat constant i més lenta, que permeti la seva lectura”, puntualitza la investigadora), però és força senzilla, i el nivell d’informació és molt més gran.
Els kits comercials de Nanopore permeten seqüenciar ARNm, i fa temps que es fan servir, perquè l’abundància dels ARNm es pot utilitzar efectivament com a biomarcador d’alguns càncers. Però els ARNm són poc abundants i cal seqüenciar-ne moltíssims per trobar diferències entre mostres amb o sense càncer. Els ARNs no codificants (com els ARNt amb els que treballen al grup de Novoa), en canvi, són molt més abundants, i per tant molt més informatius i millors biomarcadors, amb més capacitat diagnòstica.
El grup dirigit per Eva Novoa ha aconseguit seqüenciar els ARN de transferència amb Nanopore, que són els més informatius però molt petits i difícils de detectar.
Per això, des que van sorgir els primers kits de Nanopore, el laboratori de Novoa i d’altres arreu del món han estat fent adaptacions d’aquesta tecnologia per permetre seqüenciar altres tipus d’ARN més enllà dels ARNm. Un repte amb els ARNts, però, és que són unes molècules molt curtes – i per tant, es perdien i no es seqüenciaven bé amb el Nanopore. “El que hem aconseguit ara és seqüenciar bé aquests ARNts. Hem demostrat que podem capturar moltíssimes molècules, detectant les abundàncies correctes i les seves modificacions diferencials”, especifica la cap de grup. Ho han aconseguit gràcies a modificacions en la preparació de les llibreries, i també en l’anàlisi informàtica, en la que utilitzen algorismes i intel·ligència artificial per analitzar les seqüències i fer prediccions.
De prova de concepte a diagnòstic clínic
Però, abans d’utilitzar aquesta seqüenciació d’ARNt per fer diagnòstic a nivell clínic, cal entendre millor quines modificacions específiques estan lligades a quins tipus de càncer. “En coneixem algunes, però no s’han analitzat de forma exhaustiva, precisament perquè fins ara no es podien analitzar aquestes modificacions de forma ‘no dirigida’; tothom mirava les 4-5 modificacions que es coneixien i eren més senzilles de mirar”, diu Novoa. Però ara poden fer aquesta ‘fotografía’, i aquest serà el primer pas; estudiar i classificar les modificacions vinculades a cada càncer.
Per a fer-ho, el grup està ara buscant mostres de pacients – per començar, de càncer de mama i de colon – tant a biobancs com en col·laboració amb metges a hospitals. “Necessitem mostres variades, de diferents tipus de càncer, i ben estratificades, per obtenir el màxim d’informació”, afirma la investigadora.
Després caldrà optimitzar la seqüenciació del plasma, ja que fins ara han fet els estudis amb línies cel·lulars.
I finalment hauran d’entrenar el model computacional, de forma que a mesura que es van seqüenciant els ARNs, vagi fent prediccions. “Fins on arribaran aquestes prediccions, no ho sabem. Potser només fins a dir si la mostra és de càncer o no – encara que jo crec que quasi segur que també podrà detectar de quin teixit ve”, assegura la biòloga. “Potser podrà dir si és un càncer metastàsic o no. O si és resistent a un determinat tractament. O en quin estadi està… Tot dependrà de la quantitat d’informació que tinguem per entrenar el model”.
L’objectiu final seria fer servir aquesta tecnologia per a fer cribatges i diagnòstic precoç, perquè com abans es detecti el càncer, més probabilitat de supervivència i menor cost pel sistema de salut.
L’objectiu seria utilitzar aquesta tecnologia per a fer cribatges i diagnòstic precoç de molts tipus de càncer alhora.
A més de ser un aparell petit i molt portable – el que facilitaria el seu ús a llocs sense grans infraestructures, ja que necessita només un bon ordinador i electricitat – la seqüenciació d’ARNs amb la tecnologia Nanopore permetria fer un cribatge de molts càncers alhora. “Quan fem una mamografia, per exemple, a part de que té un cost, només estem mirant càncer de pit. Però a l’analitzar una mostra de sang amb Nanopore, creiem que podrem veure indicis de qualsevol càncer. Després òbviament caldria fer altres proves per validar els resultats, però seria un gran primer pas”, conclou Novoa.