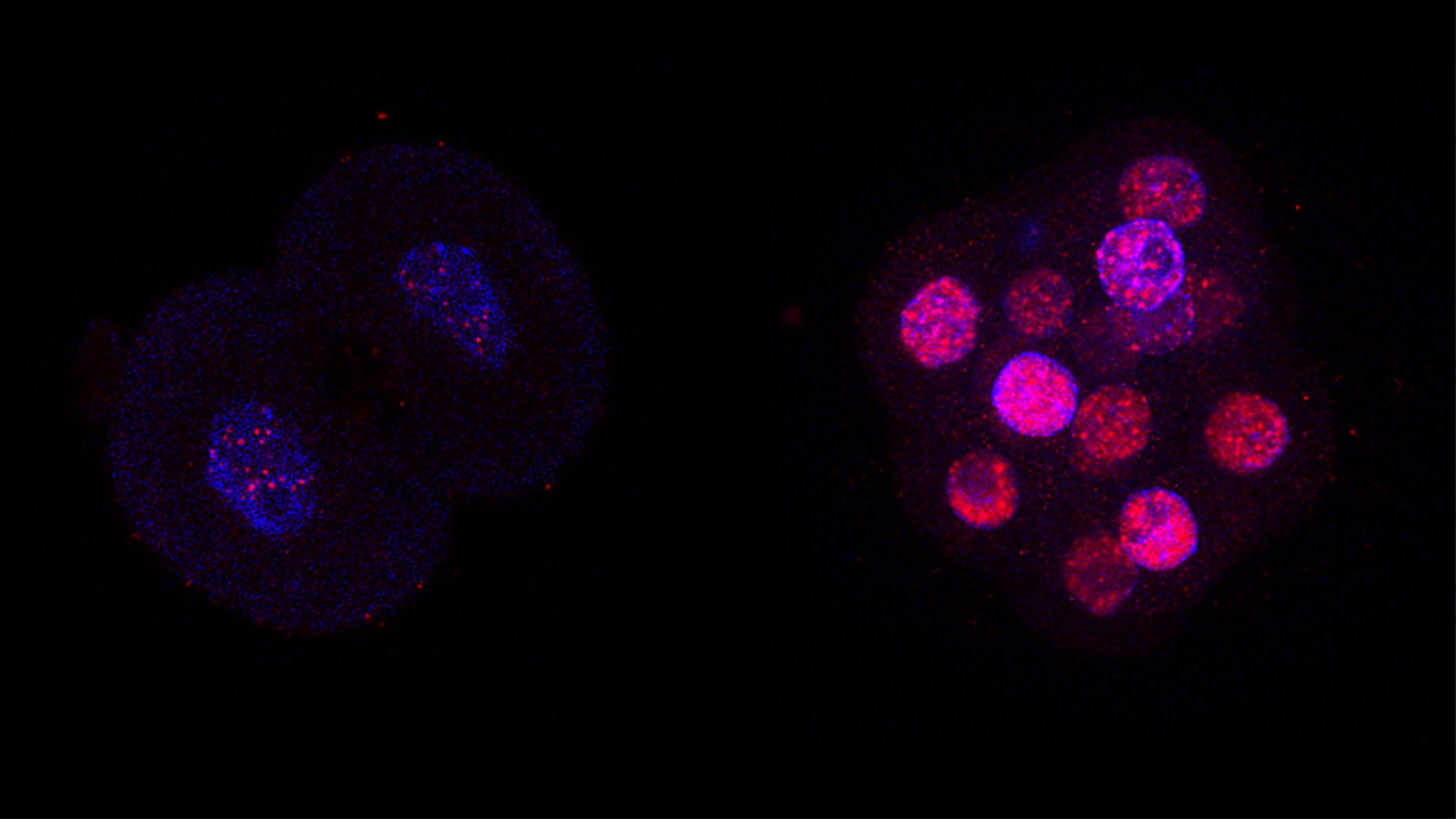
Durant el desenvolupament embrionari dels mamífers es produeix una desregulació a l’empalmament alternatiu, un procés biològic fonamental. Un equip científic del Centre de Regulació Genòmica (CRG) va descobrir aquest fenomen en crear un atles d’esdeveniments d’empalmament durant el desenvolupament primerenc de vaques, ratolins i humans.
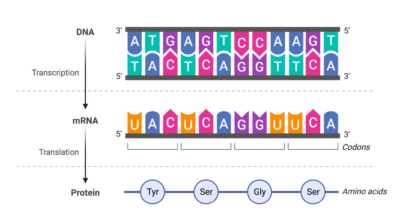
L’empalmament alternatiu és un mecanisme molecular que permet produir una gran diversitat d’ARNm i, per tant, proteïnes, a partir d’un nombre limitat de gens. Es basa en crear diferents combinacions dels exons o seqüències codificants d’un gen. A més, és un mecanisme de vital importància per al desenvolupament de cèl·lules complexes com les dels músculs o les neurones, per la qual cosa és un procés altament regulat.
A l’estudi, l’equip científic va observar que, quan els embrions només comptaven amb 8 cèl·lules, la varietat d’ARNm alternatius era la més alta registrada en qualsevol cèl·lula o teixit fins a la data, mentre que, en la següent etapa del desenvolupament, aquesta varietat disminuïa a nivells normals. Això evidencia un col·lapse temporal en la regulació de l’empalmament alternatiu durant l’activació del genoma cigòtic; és a dir, quan un embrió comença a fer servir les seves pròpies proteïnes i ARN i deixa d’usar els materns.
Manuel Irimia, autor principal de l’estudi, comenta que creuen que és un acte deliberat de sabotatge. “Creiem que això passa perquè hi ha instruccions al nostre genoma que diuen a alguns gens – en concret hem vist que són gens involucrats en la reparació de l’ADN – que no facin la seva feina en aquesta etapa de desenvolupament. Creiem que en el moment que l’embrió comença per primera vegada a transcriure el seu ADN poden ocórrer molts errors que sobreactivarien aquestes proteïnes. Per això, el mateix zigot les inhibeix abans”, apunta. En efecte, s’ha vist que en aquesta etapa la resposta al dany a l’ADN és baixa, i aquest ‘autosabotatge‘ podria ser una de les raons.
“Les cèl·lules de l’embrió fan malbé el seu empalmament a propòsit i ho fan per una raó funcional”
Manuel Irimia
Aquestes troballes resulten molt interessants des del punt de vista de la medicina regenerativa, ja que podria suposar un avenç en la creació de cèl·lules totipotents a partir de cèl·lules mare. Tal com diu Irimia, “creiem que el fracàs programat de la regulació de l’empalmament també passa en altres contextos fisiològics”. I conclou que “tan sols estem començant a desglossar la importància que té aquest mecanisme per als processos biològics”.
Christopher D. R. Wyatt, Barbara Pernaute, André Gohr, Marta Miret-Cuesta, Lucia Goyeneche, Quirze Rovira, Marion C. Salzer, Elvan Boke, Ozren Bogdanovic, Sophie Bonnal, Manuel Irimia. A developmentally programmed splicing failure contributes to DNA damage response attenuation during mammalian zygotic genome activation. Science Advances, 2022; 8 (15) DOI: 10.1126/sciadv.abn4935