Miki Ebisuya creó su grupo de investigación en el Laboratorio Europeo de Biología Molecular – Barcelona (EMBL Barcelona) hace un año. No obstante, hasta este verano su grupo no se ha asentado al 100%. «Uno de mis investigadores postdoctorales (que es también mi marido) ha mantenido el grupo en Japón a lo largo de este año, acabando de cerrar asuntos y trasladándolos aquí. Él se vino a Barcelona hace solo unos meses», comenta Ebisuya.
Equipamiento especial
Los microscopios que han llegado a la 4a planta del Parque de Investigación Biomédica de Barcelona (PRBB) – donde se encuentra EMBL Barcelona – no son convencionales. «Disponemos de microscopios confocales tradicionales, pero también de un microscopio personalizado que desarrollamos conjuntamente con la compañía Olympus en Japón. Por eso estamos esperando a que esta compañía japonesa venga y lo instale; la sede europea de dicha compañía no vende estos microscopios», explica la líder del grupo.
Lo que hace especial a este microscopio es que detecta bioluminiscencia, en lugar de fluorescencia – que es la manera más común de marcar células vivas.
La bioluminiscencia – lo que las luciérnagas usan para brillar – no requiere excitación. Se trata de una reacción enzimática que cataliza la oxidación del sustrato luciferina, generando luz. Para el grupo, la bioluminiscencia tiene ventajas interesantes.
«Usamos un microscopio personalizado que hemos desarrollado conjuntamente con la compañía Olympus en Japón, que detecta bioluminiscencia, en lugar de fluorescencia»
«Estamos estudiando las oscilaciones (genes que pasan de un estado activo a uno inactivo de manera cíclica), y esto se detecta como pulsos de luz (cuando un gen en concreto se expresa, la señal de bioluminiscencia aumenta). Debido a que la periodicidad de los ciclos que estudiamos es breve (se repiten cada 2-5h), no podemos usar proteínas fluorescentes, como GFP, ¡pues tienen una vida media de ~24h! Si las usáramos, cuando apareciese el siguiente pulso, todavía estaríamos viendo la luz del primero… Y si desestabilizamos la proteína fluorescente, la señal se vuelve demasiado débil como para ser detectada», explica la líder del grupo. Por suerte, la bioluminiscencia no genera ruido de fondo, como sí lo hace la fluorescencia, de modo que el tiempo de exposición se puede extender a entre 5 y 10 minutos. Esto significa que incluso una señal débil puede ser detectada.
«Haciendo» biología para entender los principios
El laboratorio se centra en la biología sintética del desarrollo. La mitad del laboratorio intenta reconstituir artificialmente mecanismos de desarrollo, mientras que la otra mitad intenta recrearlos in vitro, mediante células madre. En ambos casos, el objetivo es el mismo: entender los principios que hay detrás de estos mecanismos de desarrollo usando sistemas in vitro. Han estado trabajando en cuatro procesos:
3- Deformación de tejidos
4- Oscilaciones
La mitad del laboratorio intenta reconstituir artificialmente mecanismos de desarrollo, mientras que la otra mitad intenta recrearlos in vitro, mediante células madre
1. Ruptura de la simetría
Los primeros dos proyectos los llevó a cabo Ebisuya cuando todavía estaba en Japón. Para el primero, usaron células CHO (células de hámster muy usadas en cultivos celulares), las cuales no disponen de un mecanismo endógeno de ruptura de simetría intercelular. Los investigadores introdujeron un circuito genético artificial basado en la señalización Delta-Notch (conocida por estar involucrada en la división celular asimétrica) y consiguieron que estas células se dividiesen en dos tipos celulares que expresan marcadores distintos. Con este experimento, el grupo ha demostrado que el sistema Notch no es solo necesario, sino suficiente para generar una ruptura de la simetría. Recrear el fenotipo artificialmente es la prueba definitiva del mecanismo que hay detrás. «También hemos aprendido algo nuevo, ya que algunos componentes del sistema no actúan de la manera esperada», añade Ebisuya.
«Recrear el fenotipo artificialmente es la prueba definitiva del mecanismo que hay detrás»
2. Formación de patrones
Los patrones son básicos en desarrollo; por ejemplo, nuestras manos siguen un patrón (dedo, espacio, dedo, espacio, dedo, espacio, y así hasta cinco veces). El segundo proyecto del laboratorio fue recrear un patrón celular de forma sintética. Esta vez, usaron células de mamífero HEK293 a las cuales les introdujeron un circuito genético que recrea el sistema de reacción-difusión, un modelo matemático que explica cómo la interacción de múltiples moléculas difusibles puede dar lugar a patrones en el espacio.
Con este nuevo circuito, las células empiezan a comunicarse las unas con las otras enviando señales que activan a sus vecinas e inhiben aquellas células que se encuentran más lejos. Esto genera un patrón de áreas en positivo y negativo (es decir, áreas en las que un gen es expresado o inhibido). El sistema de reacción-difusión es conocido por estar involucrado en este proceso, y las simulaciones computacionales lo han estado probando durante mucho tiempo – pero «crearlo desde cero, con células, genes y proteínas reales, ¡es otra historia!», comenta Ebisuya.
3. Deformación de tejidos
Tanto la ruptura de la simetría como la formación de patrones son esenciales en el desarrollo, pero se trata de mecanismos de 1 o 2 dimensiones. Y el desarrollo tiene lugar en 3D, de modo que el grupo intenta ahora manipular la forma de los tejidos. Están usando láminas de células epiteliales en un gel con el objetivo de doblar dichas láminas. Como con los proyectos anteriores, lo que quiere el grupo es probar la suficiencia del mecanismo que se conoce actualmente (en este caso, la constricción apical) y descubrir si existen nuevos mecanismos.
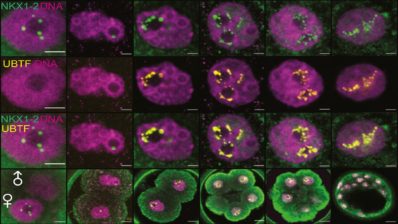
4. Oscilaciones: el problema de «el tiempo del elefante, el tiempo del ratón»
Otra parte del laboratorio usa células madre para recapitular mecanismos naturales del desarrollo, en lugar de reconstituirlos desde cero. «Todavía es in vitro«, sonríe la líder del grupo, «solo que un poco menos artificial».
La científica recuerda leer, en el instituto, un libro japonés titulado El tiempo del elefante, el tiempo del ratón. Este libro le enseñó que diferentes especies tienen diferentes ciclos temporales; los animales más grandes viven más tiempo, su corazón late más lento, el periodo de gestación es más largo… «Desgraciadamente, el libro no me respondía al por qué, de modo que las preguntas se quedaron conmigo», recuerda la bióloga.
Diferentes especies tienen ciclos temporales distintos; los animales más grandes tienden a vivir más, pero no se sabe por qué. Mediante células madre, el laboratorio intenta recapitular estos mecanismos en diferentes especies in vitro, y compararlas en las mismas condiciones.
«Siempre he pensado que este era un problema de muy difícil estudio, ya que es complicado comparar qué sucede en diferentes especies cuando nos encontramos con ambientes corporales tan diversos; diferente número de células, diferente nutrición, etc. Pero ahora, gracias a las células madre pluripotentes inducidas (iPS) y a las células madre embrionarias (ES), podemos recapitular estos mecanismos en diferentes especies in vitro, y compararlas entre ellas bajo las mismas condiciones en cultivos celulares», afirma Ebisuya.
Actualmente, el grupo está estudiando el reloj de segmentación, un tipo de oscilación que tiene lugar durante el desarrollo. El tiempo de oscilación del reloj de segmentación humano va más lento que el del ratón. El laboratorio usa células madre pluripotentes de humano y ratón para recapitular los relojes de segmentación in vitro, estudiando así la causa de las diferencias entre especies en cuanto a tiempos biológicos. «Nuestro último objetivo sería modificar algo en células humanas y conseguir que adquieran el mismo ciclo temporal que un ratón, y viceversa. Esto significaría que hemos entendido los principios escondidos tras estas diferencias», concluye la investigadora japonesa.
La unión Barcelona-Japón
Ebisuya está ya bastante asentada en Barcelona. «Todavía me impresiona la belleza del PRBB y los grupos tan interesantes que hay aquí», dice. Pero esto no significa que se olvide de sus orígenes.
«Todavía me impresiona la belleza del PRBB y los grupos tan interesantes que hay aquí»
Miki Ebisuya
En un intento de, por una parte, mantener el contacto con sus antiguos compañeros en Japón y, por otra parte, conocer a sus nuevos vecinos, Ebisuya ha organizado el Encuentro Japón-Barcelona sobre Morfogénesis en 3D, que tendrá lugar en el PRBB los días 21 y 22 de octubre. La investigadora anima al personal del PRBB, así como a la gran comunidad de investigadores de Barcelona, a asistir. Es gratuito, pero es necesario registrarse a través de la web, informa la líder del grupo.

La joven líder del grupo explica los motivos que hay tras este encuentro: «Japón es un país muy aislado, y debido a la geografía y a la barrera del idioma, es muy complicado comunicarse con investigadores de otras partes del mundo… Pero existen muchos investigadores interesantes allí – así como aquí en Barcelona. ¡Así que quise organizar un evento donde se pudieran encontrar!».
Ebisuya anima al personal del PRBB, así como a la gran comunidad científica de Barcelona, a asistir al próximo Encuentro Japón-Barcelona sobre Morfogénesis en 3D.
Construyendo una comunidad
Ebisuya está muy interesada en crear comunidades. En el PRBB ha encontrado buenos colaboradores, como Jordi Garcia Ojalvo, del Departamento de Ciencias Experimentales y de la Salud, Universidad Pompeu Fabra (DCEXS-UPF). «Conocía su trabajo, ¡pero no sabía que se encontraba en el mismo edificio! De hecho, creía que estaba en EEUU, ya que colabora con muchos laboratorios americanos», admite. Garcia Ojalvo es su colaborador ideal, añade: es experto en oscilaciones y está familiarizado con la biología sintética. «Está muy ocupado pero, gracias a que estamos en el mismo edificio, puedo acercarme a su despacho y hablar ni que sea cinco minutos. Esto ha facilitado nuestra colaboración y, de hecho, ya hemos publicado un preprint en bioRxiv!», explica la científica.
Ebisuya también forma parte de una nueva serie mensual de seminarios en el PRBB, el club de biología del desarrollo, con grupos del EMBL, DCEXS-UPF, el Centro de Regulación Genómica (CRG) y el Instituto Hospital del Mar de Investigaciones Médicas (IMIM). «¡Es muy positivo conocer a mis vecinos!», concluye.