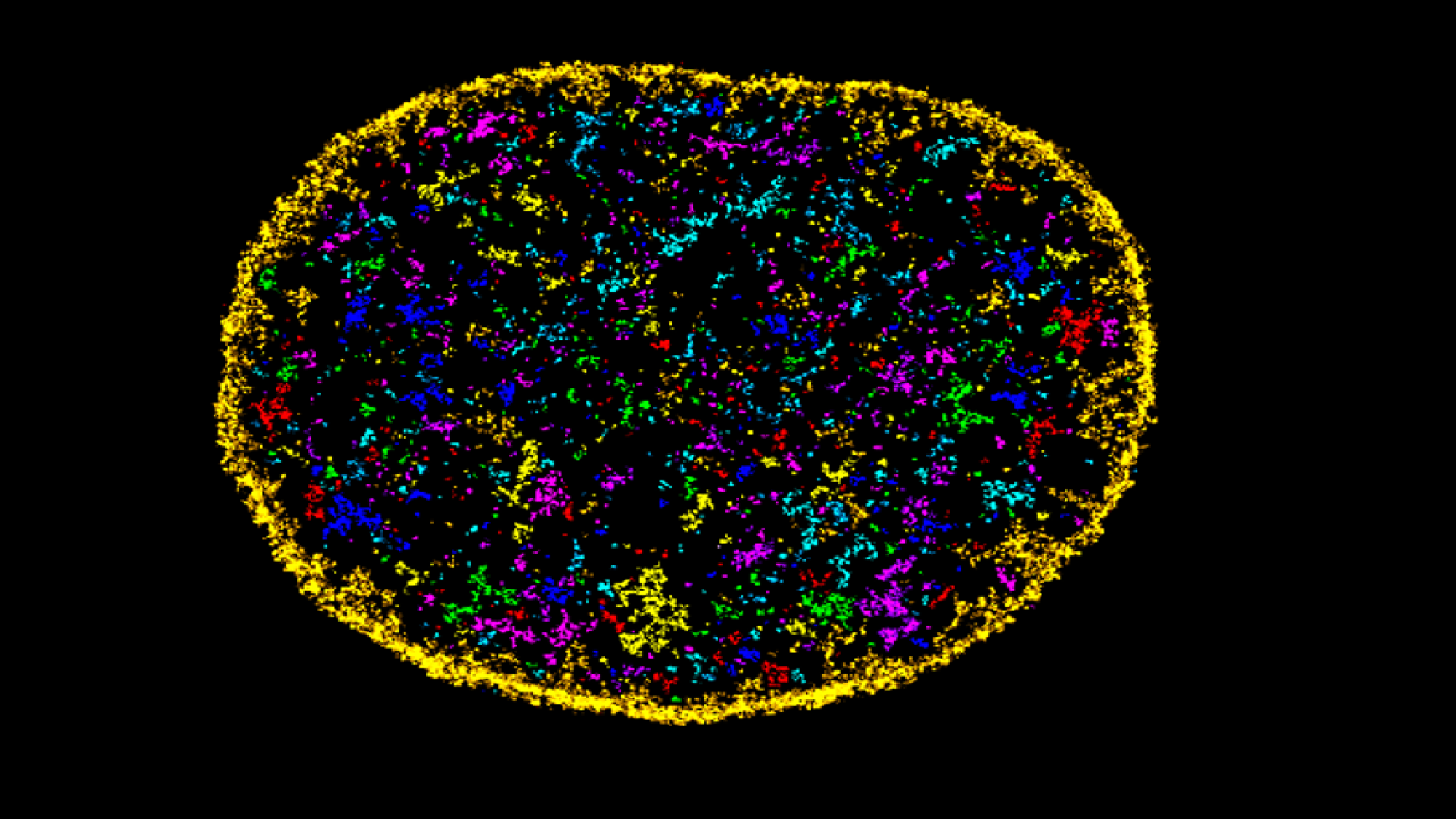
Equips investigadors del Centre de Regulació Genòmica (CRG) i de la Universitat del País Basc han desenvolupat una eina d’intel·ligència artificial, AINU (IA del NUcli), capaç d’escanejar imatges d’alta resolució de cèl·lules, a un nivell de precisió nanomètric, i detectar reordenaments de tan sols 20 nm, és a dir, 5.000 vegades menys que l’amplada d’un cabell humà.
«Aquests reordenaments poden ser canvis en l’organització de l’ADN dins de les cèl·lules o en la distribució d’enzims al nucli. Ambdues coses poden canviar en les cèl·lules canceroses. O també pot detectar petites diferències en la densitat de l’ADN després d’una infecció vírica», explica Pia Cosma, professora de recerca ICREA i cap del grup CRG responsable de l’estudi.
De fet, la IA va ser capaç de detectar canvis en el nucli d’una cèl·lula tan aviat com una hora després de ser infectada pel virus de l’herpes simple tipus 1.
Les aplicacions clíniques d’aquesta eina estan encara a anys vista, perquè precisen imatges preses amb una tècnica especial de microscòpia anomenada STORM, que només pot analitzar unes poques cèl·lules alhora, i es tracta d’un equip molt especialitzat que requeriria grans inversions.
Però l’equip investigador espera que AINU sigui ja útil en la investigació científica, per exemple identificant cèl·lules mare amb una precisió molt alta, cosa que ajudaria que les teràpies amb cèl·lules mare fossin més segures i eficaces.
Un algoritme detectiu per seleccionar el millor fàrmac
Una altra eina, RTDetective, ha estat desenvolupada conjuntament pel CRG i l’IRB. RTDetectiu és capaç de predir quins fàrmacs seran més eficaços per tractar malalties causades per «mutacions sense sentit», un tipus de mutacions que actuen com un senyal de stop que impedeix la síntesi de la proteïna completa.
Ja existeixen «teràpies de supressió de mutacions sense sentit», fàrmacs que ajuden les cèl·lules a ignorar aquests senyals de parada i continuar amb la producció de proteïnes. Però no tots funcionen igual de bé per a totes les mutacions, perquè la seva capacitat per permetre que la maquinària cel·lular «llegeixi» la mutació sense sentit depèn no només de la pròpia mutació, sinó també del codi genètic que l’envolta immediatament.
«A un pacient se li diagnostica un trastorn genètic, s’identifica la mutació mitjançant proves genètiques i un model informàtic suggereix el millor fàrmac. Aquesta presa de decisions informada és la promesa de la medicina personalitzada que esperem desbloquejar en el futur»
Ben Lehner, Professor de Recerca ICREA, CRG i Institut Wellcome Sanger
L’equip investigador va analitzar 5.800 senyals de parada prematura causants de malalties i va provar l’eficàcia de vuit fàrmacs diferents en cadascuna d’elles. Les dades (140.000 mesuraments individuals) van ser suficients com per entrenar models predictius precisos, que es van utilitzar per crear RTDetective.
El següent objectiu de la recerca és confirmar la funcionalitat de les proteïnes produïdes mitjançant l’ús d’aquests fàrmacs, un pas crucial per validar la seva aplicabilitat clínica.
Carnevali, D., Zhong, L., González-Almela, E. et al. A deep learning method that identifies cellular heterogeneity using nanoscale nuclear features. Nat Mach Intell (2024). https://doi.org/10.1038/s42256-024-00883-x
Toledano, I., Supek, F. & Lehner, B. Genome-scale quantification and prediction of pathogenic stop codon readthrough by small molecules. Nat Genet (2024). https://doi.org/10.1038/s41588-024-01878-5