A l’hora de receptar un medicament no se sol tenir en compte la informació genètica del pacient. Però una deficiència en el gen G6PD, per exemple, pot provocar fatiga o dolors abdominals a qui prengui una simple aspirina.
Per això la farmacogenòmica – l’estudi dels efectes dels medicaments segons la genètica dels individus – és actualment un camp emergent. Pot obrir les portes cap a una medicina personalitzada on, en un futur, es podrien realitzar proves genètiques senzilles combinades amb intel·ligència artificial (IA) per identificar pacients vulnerables, o adjuntar el nostre perfil farmacogenètic al nostre historial clínic.
Ara, una investigació internacional liderada per l’Institut de Biologia Evolutiva (IBE: CSIC-UPF) ha desenvolupat un dels estudis més amplis sobre la influència de la variació genètica dels individus en la toxicitat que els provoquen certs medicaments. Aquest estudi ha utilitzat bases de dades públiques, dels projectes 1000 genomes (1000G), Simmons Genome Diversity Project (SGDP) i Human Genome Diversity Project (HGDP), per analitzar dades genètiques de 3.714 persones de diferents ascendències de tots cinc continents, centrant-se en l’impacte de 1.136 variants genètiques associades amb la toxicitat de certs grups de fàrmacs. Mitjançant l’ús de tècniques d’intel·ligència artificial , l’equip ha pogut establir patrons de risc de toxicitat que podrien ser de gran utilitat en el camí cap a una medicina més personalitzada.
“El fet que observem diferències entre poblacions per aquestes variants suggereix que seria interessant incloure l’ancestria genètica de l’individu a l’hora de fer estudis de toxicitat, per arribar a tenir tractaments més personalitzats”.
Òscar Lao, investigador principal de l’estudi
Els resultats revelen que les poblacions d’ascendència americana i europea presenten un risc més elevat de patir toxicitat en un ventall ampli de fàrmacs. En particular, s’ha detectat una major susceptibilitat a fàrmacs cardiovasculars i antimicrobians en aquestes poblacions. A més, les poblacions americanes mostren un risc alt amb antidepressius i analgèsics, mentre que les europees són més vulnerables als immunosupressors i als fàrmacs anticancerosos. A l’altre extrem, les poblacions d’ascendència de l’est asiàtic i, en menor mesura, les d’ascendència oceànica, presenten un risc molt baix de toxicitat en general, amb l’excepció d’algunes poblacions d’Àsia central que mostren sensibilitat als analgèsics. Les poblacions africanes es troben en una situació intermèdia, amb més varietat en les respostes.
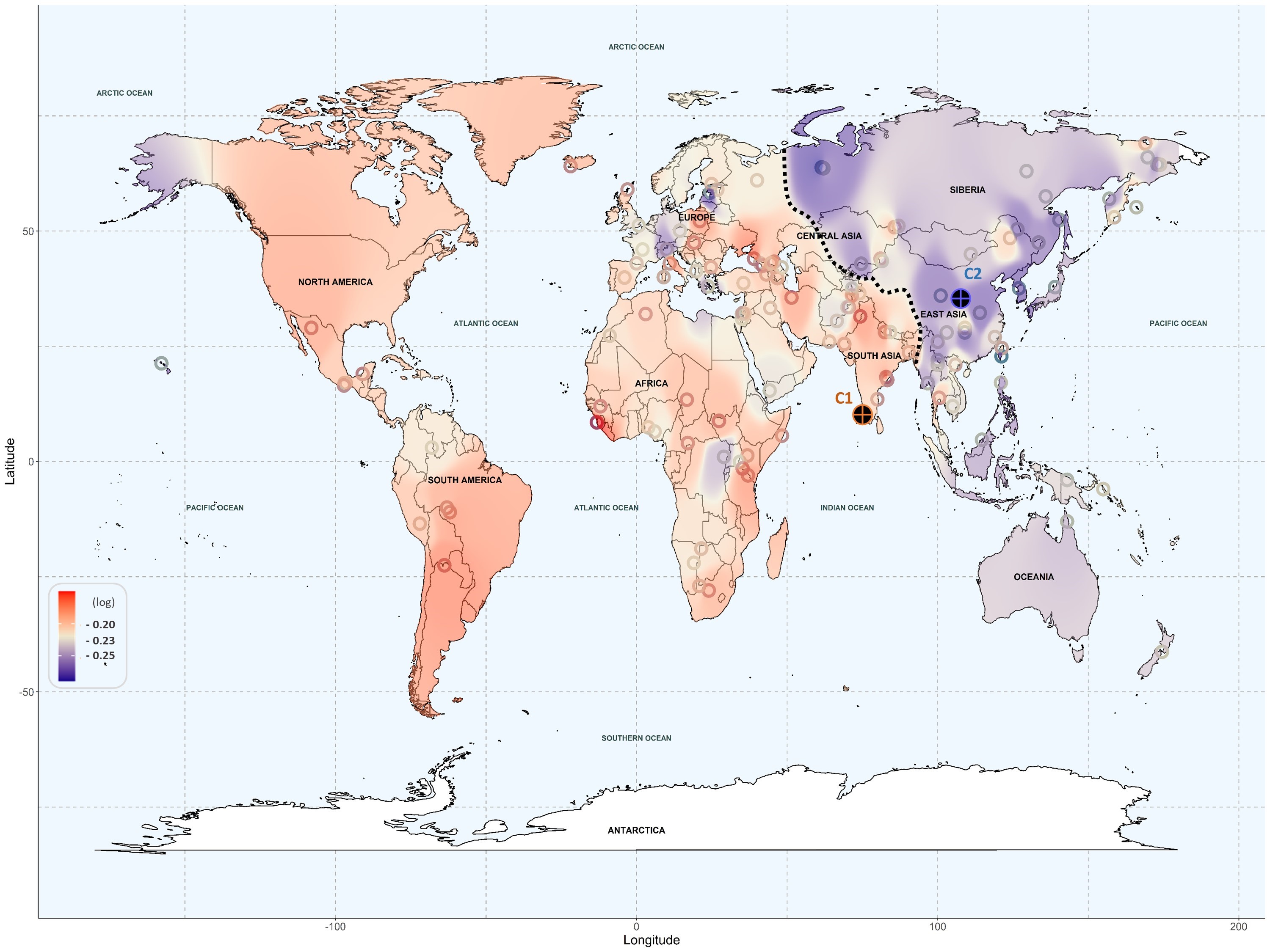
Per dur a terme l’anàlisi genòmica, els investigadors han utilitzat tècniques de machine learning per estudiar la funció de gens implicats en l’absorció i el transport de fàrmacs. A més, la mineria de textos (text mining), que es basa en l’obtenció d’informació a partir de dades en text, ha permès extreure i agrupar variants genètiques, tot relacionant-les amb ascendències genètiques de regions geogràfiques concretes. Aquestes tècniques han revelat patrons de risc genètic que poden tenir un gran impacte en la medicina personalitzada.
“En última instància, però, el risc de patir efectes adversos és específic de cada individu, més enllà de la seva ancestria. Idealment ens haurien de seqüenciar tot el genoma per poder establir els nostres patrons de risc”, adverteix Òscar Lao, investigador principal de l’estudi.
Karamperis, K., Katz, S., Melograna, F., Ganau, F. P., Van Steen, K., Patrinos, G. P., Lao, O. (2024). Genetic ancestry in population pharmacogenomics unravels distinct geographical patterns related to drug toxicity, iScience, 27(10). DOI:10.1016/j.isci.2024.110916