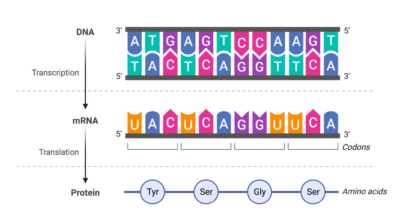
Totes i cadascuna de les proteïnes del nostre cos estan constituïdes per cadenes d’aminoàcids. Quan un d’aquests aminoàcids pateix una mutació, tota la proteïna pot resultar afectada, sovint marcant la diferència entre salut i malaltia. Això passa perquè l’estructura de la proteïna canvia, la qual cosa pot impedir la seva funció. Però mesurar experimentalment com diferents mutacions afecten l’estructura i funció d’una proteïna resulta impossible, ja que hi ha masses combinacions a provar. Per posar un exemple, en una proteïna formada per 34 aminoàcids, hi ha 17 mil milions de combinacions diferents si només es permet un únic canvi a cada posició. I la majoria de proteïnes humanes són molt més grans que això.
Fins fa ben poc, s’assumia que sovint una mutació podia afectar una altra mutació augmentant-ne o suprimint-ne els efectes. Ara, un estudi del Centre de Regulació Genòmica (CRG) amb col·laboració del Wellcome Sanger Institute ha descobert que les interaccions entre mutacions són menys comuns del que es creia. Això significa que la gran majoria de mutacions afecten una proteïna de manera independent.
Descobrir que les mutacions no solen interactuar entre elles significa que l’estabilitat de les proteïnes queda afectada per mutacions seguint regles molt més senzilles que els càlculs que es feien fins ara. L’equip investigador, dirigit per André Faure i Ben Lehner, va analitzar seqüències de proteïnes amb diferents combinacions de mutacions i en van provar l’estabilitat. El resultat experimental va ser molt semblant al dels models que calculaven l’efecte total de les mutacions com una simple suma de totes elles, és a dir, considerant-les independents. Tot i això, en el cas de tenir tres o més mutacions, el model no ha estat capaç de predir l’estructura de la proteïna.
“Hem vist que no necessitem superordinadors per predir el comportament d’una proteïna; només calen mesures i matemàtiques senzilles.”
Ben Lehner (CRG i Wellcome Sanger Institute)
Tot i així, encara cal un cert nivell de validació experimental per confirmar les prediccions, especialment per a aplicacions crítiques com el desenvolupament de fàrmacs on hi pot haver efectes imprevistos o interaccions poc freqüents que els models no capturen. Però aquesta recerca servirà per optimitzar el nombre d’experiments necessaris per analitzar l’estructura de proteïnes i poder-la predir, fet que suposa un avenç en el disseny de proteïnes amb potencial farmacològic i biotecnològic.
Faure, A.J., Martí-Aranda, A., Hidalgo-Carcedo, C. et al. The genetic architecture of protein stability. Nature (2024). https://doi.org/10.1038/s41586-024-07966-0