Tras 10 años de trabajo, un equipo del Centro de Regulación Genómica (CRG) de Barcelona, dirigido por Juan Valcárcel, ha completado un estudio pionero que revela el primer mapa del espliceosoma (spliceosome en inglés), una máquina molecular crucial y compleja responsable de la edición del ARN en todas las células humanas.
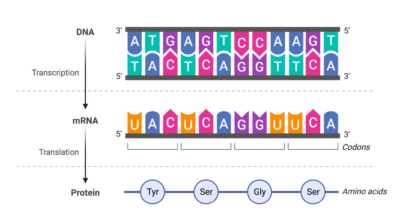
El espliceosoma, o complejo de corte y empalme del ARN, está compuesto por 150 proteínas y cinco moléculas de ARN, y desempeña un papel fundamental en el splicing o empalme, un proceso que permite a las células producir diversas proteínas a partir de un único gen. En realidad, más del 90% de los genes son objeto de splicing, y los errores de empalme están relacionados con numerosas enfermedades, entre ellas el cáncer y las afecciones neurodegenerativas. Pero la intrincada naturaleza del espliceosoma ha dificultado su estudio hasta ahora.
El equipo del CRG alteró la expresión de 305 genes relacionados con el espliceosoma en células cancerosas humanas, uno a uno, observando los efectos sobre el splicing en todo el genoma. De este modo, descubrieron especializaciones hasta ahora desconocidas de los componentes del espliceosoma, revelando sus distintas funciones en el proceso de empalme.
La alteración de la expresión de 305 genes relacionados con el espliceosoma en células cancerosas humanas, uno por uno, demostró que los componentes individuales del espliceosoma están mucho más especializados de lo que se pensaba.
Este nuevo hallazgo podría allanar el camino a terapias dirigidas, más eficaces y con menos efectos secundarios, ya que muchos componentes que antes se pasaban por alto debido a sus funciones desconocidas podrían considerarse ahora para el desarrollo de fármacos.
“Si imaginamos el proceso de empalme como la posproducción de una película, el espliceosoma es la oficina en la que muchas docenas de editores revisan el material y toman decisiones rápidas sobre si una escena pasa al corte final”, afirma Malgorzata Rogalska, coautora del estudio. Pero hay un giro inesperado en esta “producción de Hollywood”. “Cualquiera de los colaboradores puede tomar las riendas y convertirse en el director. Y en lugar de que la producción se venga abajo, esto da lugar a una versión diferente de la película. Es un nivel de democratización sorprendente que no habíamos previsto”, añade.
Otro descubrimiento clave es que, debido al alto nivel de interconectividad, la alteración de cualquier parte de la red del espliceosoma puede tener efectos en cascada en todo el sistema. Esto podría aprovecharse para atacar a las células cancerosas, en las que la maquinaria de empalme suele desregularse. Por ejemplo, las alteraciones en el componente del espliceosoma SF3B1 – que está mutado en muchos tipos de cáncer, como el melanoma, la leucemia y el cáncer de mama – provocaron fallos generalizados de empalme en la célula, anulando su capacidad para seguir creciendo. Esto podría suponer un posible “talón de Aquiles” para el tratamiento del cáncer.
«Los cánceres se adaptan reorganizando su maquinaria de empalme. Si obstruimos este empalme, podríamos llevar a las células enfermas más allá de un punto de inflexión que no puede ser compensado, lo que lleva a su autodestrucción»
Juan Valcárcel ( CRG), autor principal del estudio
El mapa también promete mejorar nuestra capacidad para diagnosticar y tratar enfermedades causadas por errores de empalme. En la actualidad, los tratamientos dirigidos a los defectos de empalme se limitan a enfermedades raras, pero el nuevo mapa podría ayudar a los y las investigadoras a determinar con exactitud dónde se producen los errores de empalme y ayudar a extender estas terapias a una gama más amplia de afecciones.
El CRG ha hecho público el mapa, con la esperanza de acelerar el desarrollo de nuevos tratamientos basados en el splicing y hacerlos más accesibles a la comunidad médica general.
El estudio se realizó en colaboración con Remix Therapeutics, una empresa de biotecnología en fase clínica de Massachusetts, en Estados Unidos.
Malgorzata E. Rogalska et al. Transcriptome-wide splicing network reveals specialized regulatory functions of the core spliceosome. Science 386,551-560(2024).DOI:10.1126/science.adn8105