Desde estudiantes de doctorado hasta investigadoras principales, estamos muy orgullosos de nuestra comunidad en el Parque de Investigación Biomédica de Barcelona (PRBB). Hoy queremos destacar los éxitos recientes de una investigadora principal y de un joven científico: Anna Bigas, una líder de grupo en el Instituto Hospital del Mar de Investigaciones Médicas (IMIM), y Akinola Akinbote, estudiante de doctorado en el Laboratorio Europeo de Biología Molecular – Barcelona (EMBL Barcelona).
También aprovechamos para felicitar a Ana Aldea y Antonio García de Herreros, ambos del IMIM, por sus recientes nombramientos como miembros de comités nacionales implicados en la regulación de la investigación clínica y la evaluación de los investigadores, respectivamente.
Reconocimiento para mujeres líderes
Anna Bigas, coordinadora del grupo de investigación de células madre y cáncer del IMIM ha sido elegida una de las mejores 100 mujeres líderes de España, en la categoría de Académicas, investigadoras y pensadores.
Este ranking fue creado en 2011 por Mujeres & Cia, una revista en línea de referencia para mujeres profesionales que pretende visibilizar el talento femenino y construir una sociedad basada en la igualdad.
Anna Bigas, que es también directora del CIBER de Cáncer (CIBERONC), estudia cómo se generan y renuevan las células madre que mantienen diferentes tejidos en condiciones fisiológicas. Estos procesos tienen grandes semejanzas con los que se producen en el cáncer, por lo que su trabajo se centra principalmente en el sistema hematopoyético y el proceso de leucemia.
Destacando voces africanas en STEM
Akinola Akinbote llegó al laboratorio de Kristina Haase en EMBL Barcelona hace menos de un año, pero ya ha dejado huella. Recientemente participó en el simposio 2021 «Africans in STEM» , donde ganó un premio por una destacada microcharla sobre «Ingeniería 3D de microvasculatura humana cardíaca en chip para estudiar la disfunción microvascular coronaria«. Hablamos con él de este simposio y de lo que significa para él.
En primer lugar Akinola, ¡enhorabuena por el premio! ¿Nos puedes explicar más sobre el simposio «Africans in STEM»?
¡Gracias! Africans in STEM se fundó en la Universidad de Cambridge para «destacar las contribuciones científicas de los y las africanas en ciencia, tecnología, ingeniería y matemáticas, y para permitir redes de apoyo, intercambio de ideas y colaboraciones». También están asociados con la Royal Society of Chemistry y con Cambridge Africa. Organizan simposios anuales y otros breves encuentros para reunir científicos y científicas africanas de todo el mundo, independientemente de sus ámbitos de trabajo.
¿Era la primera vez que participabas?
Sí, este era el tercer año que celebraban el simposio, pero era mi primera vez. Había entre 60 y 100 personas de todo el mundo; mayoritariamente del Reino Unido, pero también de otros países europeos y de varios países africanos, así como algunos de los Estados Unidos. También había investigadores de todos los niveles, desde estudiantes universitarios hasta profesores, y tanto en el ámbito académico como industrial.
¿Por qué es importante celebrar un simposio específico para personas de África, y qué significó para ti?
En primer lugar lo veo como una vía para conocer personas que se parecen a mí y que trabajan en STEM, donde todavía somos una minoría; y después, para conectar con investigadores que tienen una experiencia similar a la mía, que provienen de un contexto similar. Como africano venido de Nigeria, me gustaría que mi investigación ayudara a encontrar soluciones que sean relevantes para mi país, que la tecnología que estoy desarrollando se pueda utilizar en otros países de nuestro continente. Y esto necesitará de gente que haya estado o que viva allí y sepa qué es lo que hay. Este simposio me dio la oportunidad de conectar con varias personas de este tipo.
Me gustaría que las tecnologías que desarrollo fueran útiles y relevantes también para los países africanos; por eso es importants conectar con la gente que vive allí.
Akinola Akinbote (EMBL Barcelona)
¿Y qué tecnología estás desarrollando?
En el grupo Haase trabajamos con tejidos in vitro vascularizados en 3D para el modelado de enfermedades, el desarrollo de medicamentos y la medicina regenerativa.
Para superar las limitaciones de los sistemas preclínicos actuales, como los cultivos de células 2D (a los que les falta el entorno 3D) o los modelos animales (que pueden presentan diferencias específicas entre especies), se necesitan modelos in vitro en 3D. Estos pueden ser organoides o dispositivos microfluídicos; en el laboratorio Haase nos centramos en estos últimos.
Se trata de dispositivos poliméricos de 4 cm de longitud hechos con PDMS, un tipo de silicona, con un canal en medio. Llenamos este canal con células primarias humanas mezcladas con un gel de fibrina y las cultivamos durante 5-7 días; en estos dispositivos, y dadas las condiciones ambientales adecuadas, ¡se forman microvasos! Estos vasos son particularmente útiles cuando se forman en nuestros dispositivos porque los podamos perfundir con solutos relevantes para entender las propiedades de barrera de la vasculatura, que es su función principal en el oroganismo. También podemos investigar cómo se altera la barrera respecto a los cambios en el medio ambiente. Kristina, la líder del laboratorio, desarrolló estos modelos anteriormente en el MIT, donde los utilizó para examinar la salud y la disfunción vascular en el cáncer y en la placenta. En mi caso, estoy basándome en los modelos anteriores para diseñar una plataforma de vasculatura in vitro específica para el corazón.

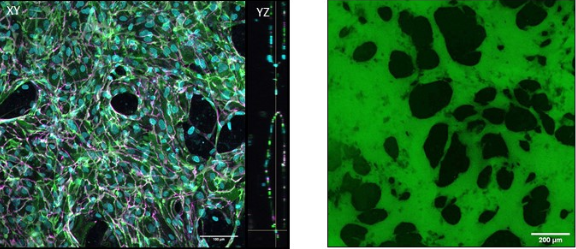
¿Para qué necesitamos vasos in vitro específicos del corazón?
Las enfermedades cardiovasculares causan cerca de 18 millones de fallecimientos anuales, y pruebas recientes han señalado que los microvasos más pequeños del corazón son los principales contribuyentes al desarrollo patológico de las enfermedades del corazón. La disfunción de estos pequeños vasos cardiacos se llama disfunción microvascular coronaria (CMD) y, aunque se están desarrollando varios modelos animales, aun necesitamos modelos humanos para comprender la CMD.
Hay que generar vasos realistas específicos del corazón para comprender su desarrollo y cómo se vuelven disfuncionales con el paso del tiempo. Como los vasos sanguíneos son característicos de cada tejido del cuerpo, debemos generarlos a partir de su tejido de origen. Por ejemplo, las células endoteliales cardíacas deben soportar los latidos constantes del corazón y regular el intercambio de nutrientes y gases en un tejido energéticamente exigente para favorecer la contracción muscular del corazón.
La construcción de estos vasos en un chip también nos permite manipular el microentorno, por ejemplo, cambiando el flujo, las condiciones hormonales o la concentración de oxígeno. Así, esperamos que la generación de vasos específicos del corazón en estos dispositivos demuestre cuáles son los contribuyentes clave a la CMD y también nos permita examinar el efecto de los tratamientos relevantes. Dada la patogénesis poco estudiada de la CMD, junto con otros factores que contribuyen relacionados con el sexo y la edad, es realmente importante generar modelos de microvasos cardiacos humanos.







