Vikas Trivedi, cap de grup a la seu més nova d’EMBL, a Barcelona, va començar com a enginyer a l’Institut de Tecnologia Kanpur a la Índia. Es va canviar al camp de la bioimatge durant el seu doctorat al laboratori de Scott Fraser a Caltech, Pasadena, EUA. “Vaig desenvolupar eines d’imatge i processament d’imatge per intentar entendre el desenvolupament del cor en peix zebra. Però el laboratori era tan interdisciplinari i col·laboratiu que vaig acabar treballant amb d’altres organismes models i altres problemes”. Més tard, es va traslladar a Cambridge, Regne Unit, per fer el seu postdoc, i només un any i mig després, a finals del 2018 es va unir al Parc de Recerca Biomèdica de Barcelona (PRBB) com a cap de grup al Laboratori Europeu de Biologia Molecular – Barcelona (EMBL).
De l’enginyeria a la biofísica
Trivedi està intentant entendre com s’auto-organitzen les cèl·lules des d’un punt de vísta físic. “En un embrió hi ha molts factors externs que afecten al seu desenvolupament, per exemple aquells subministrats per la mare o pels teixits extra-embrionaris, com podria ser el sac vitel·lí. Però jo estic interessat en la capacitat inherent de les cèl·lules embrionàries: si estan fora de l’embrió, encara poden promoure aquest desenvolupament?”, es pregunta.
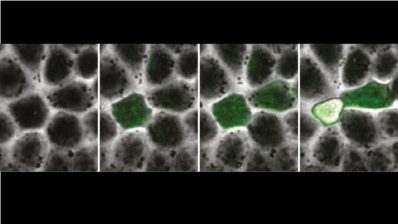
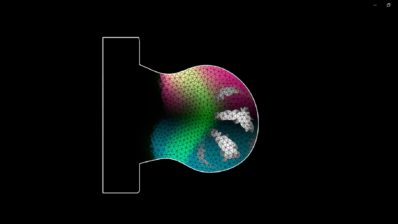
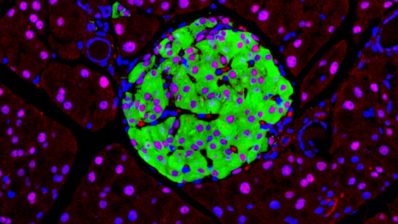
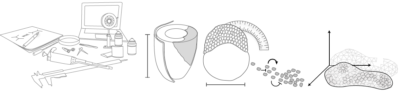
Quan va arribar al laboratori de l’Alfonso Martinez Arias a Cambridge, va descobrir els gastruloides de ratolí. Aquests són un tipus d’organoides (150-200 microns de diàmetre) generats a partir de centenars de cèl·lules mare embrionàries (ESCs) de ratolí que s’agreguen per formar una esfera. Sorprenentment, aquesta esfera sol allargar-se i desenvolupa els tres eixos del cos que recorden a l’embrió de ratolí real.
“Estem intentant entendre com s’auto-organitzen les cèl·lules des d’un punt de vísta físic utilitzant organoides”
Vikas Trivedi
“Com que havia treballat amb peix zebra durant el meu doctorat, em vaig preguntar si aquesta capacitat dels gastruloids de generar un eix sense tenir els senyals que sabem que habitualment estan presents en un embrió, era només una capacitat dels mamífers. Treballant junts amb un estudiant de màster amb molt de talent, Andrea Attardi, del laboratori de Ben Steventon, vam començar a cultivar cèl·lules d’embrions de peix zebra molt temprans i a deixar-les desenvolupar posant-les juntes. I en efecte, creaven un eix”, diu Trivedi. “A més a més, si els fas créixer suficientment, aquests agregats fins i tot creen una estructura que batega i que, casualment, no està en una posició a l’atzar sinó que sempre està al cantó oposat de la cua. Vam anomenar-los pescoids, l’equilavent del gastruloid però de peix. Mirant aquests sistemes vam pensar que potser les cèl·lules estan intentant fer un embrió polaritzat totes soles, tot i que no se’n surten del tot perquè els hi falta l’ambient instructiu i les senyals requerides de la mare”.
Quan cèl·lules embrionàries de ratolí, o de peix zebra, es treuen de l’embrió i es posen juntes, intenten crear un embrió polaritzat.
El que el seu laboratori vol entendre ara és la física que hi ha darrere d’aquest procés. En particular, fa èmfasi a dues preguntes principals: com trenquen les cèl·lules la simetria de l’esfera inicial? I, com s’organitzen les cèl·lules després per desenvolupar els eixos del cos?
Un punt de vista evolutiu
Si mirem els embrions de ratolí i peix zebra, semblen molt diferents en qüestió de formes i geometria en general. Tot i així, els gastruloids i els pescoids (els organoides embriònics assemblats fora del seu ambient natiu) s’assemblen els uns als altres tant al principi del seu desenvolupament, quan són només una bola feta de cèl·lules, fins quan s’estan allargant. Això ha fet que Trivedi es pregunti si el que veu que passa a fora de l’embrió és de fet el “programa de desenvolupament nu”, que mai podem observar en un embrió real degut a totes les altres influències que existeixen.

“Pensem que el que estem observant podria ser un mode molt fonamental de desenvolupament, i depenent de les pressions evolutives que hagi tingut les diferents espècies, han anat construint en base a aquest programa de desenvolupament inicial” explica. Si això és correcte, l’evolució hauria fet servir aquest programa fonamental de desenvolupament per construir plans corporals en diferents organismes. Per tant, Trivedi es pregunta, podriem entendre suficientment bé aquest procés de patró bàsic? Podriem fer que les cèl·lules formin una morfologia embriònica similar a la del ratolí o el peix, depenent de les condicions en què les posem?
“Creiem que el que observem en els embrions artificials podria ser el programa de desenvolupament bàsic, per defecte”
Els avantatges dels organoides
Un embrió de ratolí és molt petit comparat amb un embrió de peix o pollet. Però fan servir les mateixes xarxes genètiques per determinar la formació de l’eix. Això se sap des de fa temps. Trivedi està intentant anar més enllà dels gens i la biologia, a la física, observant els factors mecànics que actuen durant la morfogènesi. Com que estan generant aquests organoides embriònics al laboratori, poden fer-los “a la carta”. Per exemple, enlloc de les 300 cèl·lules que es fan servir normalment, poden crear un organoide embriònic amb 30 cèl·lules i un amb 3000 i mirar què passa, com s’escala l’expressió genètica. Aquests experiments no es poden fer amb un embrió. Aquesta és precisament la raó per utilitzar un sistema artificial; que pot estar controlat, ajudant a entendre com es forma – i potser també què pot anar malament. “Els defectes del desenvolupament són molt difícils d’estudiar in vivo, perquè molts mutants són letals”, explica Trivedi. El sistema artificial que està creant és prometedor per a superar aquesta dificultat.
Quan el fracàs és l’èxit
Aquestes estructures artificials amb les que treballa el grup mai acaben sobrevisquent (els gastruloids creixen durant 6 dies, i els pescoids un dia – el peix es desenvolupa més ràpid). Però això no és un problema per Trivedi; fins i tot al contrari. “El fracàs és important per nosaltres. De fet, volem que els gastruloids i els pescoids fallin en el seu intent de generar embrions; així podem entendre com rescatar-los, enginyant maneres de fer-los millor i entendre què està fent un embrió real”.
Un sistema artificial pot ser controlat i estudiat en més detall; i si no aconsegueix desenvolupar-se, podem intentar entendre perquè.
Per tal de fer aquesta feina, i degut al seu bagatge en enginyeria, el laboratori que lidera Trivedi és molt interdisciplinari. Krisztina Arato s’hi va unir l’any passat com a investigadora senior provinent d’un altre dels centres del PRBB, el Centre de Regulació Genòmica (CRG), on havia fet el seu doctorat. Kerim Anlas és el membre més jove i el primer estudiant de doctorat del grup. Tots dos venen amb uns bagatges molt potents en bioquímica, biologia molecular i imatge. El laboratori també te un fort interès en crear noves eines i tècniques; microscopis, processament d’imatges, modelatge in silico i marcatge quantitatiu en moltes mostres simultànies. A causa del l’ample rang de metodologies que volen utilitzar i implementar, el grup, que encara és jove, ha de ser molt multidisciplinari, i Trivedi vol portar gent amb diferents bagatges que es puguin entendre entre ells.
“Però la meva primera prioritat, en realitat, és crear un grup molt feliç”, diu Trivedi convençut. “Si la gent està feliç, poden passar moltes coses, encara que requereixin una mica de formació. Estic parlant des de l’experiència; durant el meu doctorat i postdoc em vaig canviar a camps desconeguts per a mi i vaig rebre molta ajuda. Vaig conèixer científics excel·lents i gent molt amable que van ser generosos amb el seu temps i energia per ensenyar-me i col·laborar sense ser territorials. Tenir un ambient de suport on la gent està disposada a recolzar una generació més jove és un privilegi; he gaudit d’aquest privilegi, i m’agradaria que el meu laboratori fos un d’aquests llocs”, conclou.
“M’agradaria que al meu laboratori hi hagués un ambient de suport, on la gent està disposada a recolzar una generació més jove”