Vikas Trivedi, jefe de grupo en el centro más nuevo de EMBL, en Barcelona, empezó como ingeniero en el Instituto de Tecnología Kanpur en India. Se pasó al campo de la bioimagen durante su doctorado en el laboratorio de Scott Fraser en Caltech, Pasadena, EUA. “Desarrollé herramientas de imagen y procesamiento de imagen para intentar entender el desarrollo del corazón en pez cebra. Pero el laboratorio era tan interdisciplinario y colaborativo que acabé trabajando en otros organismos modelo y otros problemas”. Más tarde, se trasladó a Cambridge, Reino Unido, para hacer su postdoc, y solo un año y medio después, a finales de 2018 se unió al Parque de Investigación Biomédica de Barcelona (PRBB) como líder de grupo en el Laboratorio Europeo de Biología Molecular – Barcelona (EMBL).
De la ingeniería a la biofísica
Trivedi está intentando entender cómo se auto-organizan las células des de un punto de vista físico. “En un embrión hay muchos factores externos que afectan a su desarrollo, por ejemplo los subministrados por la madre o por los tejidos extra-embriónicos, como podría ser el saco vitelino. Pero yo estoy interesado en la capacidad inherente de las células embrionarias: ¿si están fuera del embrión, aún pueden promover este desarrollo?”, se pregunta.
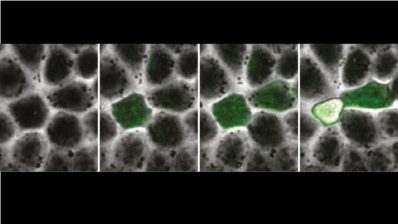
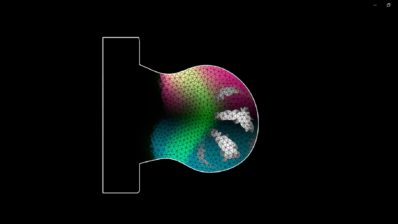
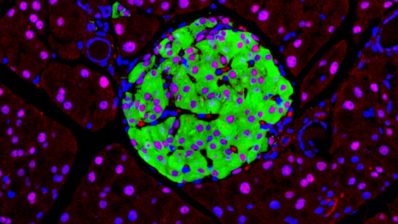
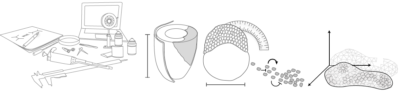
Cuando llegó al laboratorio de Alfonso Martinez Arias en Cambridge, descubrió los gastruloides de ratón. Estos son un tipo de organoides (150-200 micrones de diámetro) generados a partir de centenares de células madre embrionarias (ESCs) de ratón que se agregan para formar una esfera. Sorprendentemente, esta esfera suele alargarse y desarrolla los tres ejes del cuerpo que recuerdan al embrión de ratón real.
«Estamos intentando entender cómo se auto-organizan las células des de un punto de vista físico, utilizando organoides»
Vikas Trivedi
“Puesto que había trabajado con pez cebra durante mi doctorado, me pregunté si esta capacidad de los gastruloides de generar un eje sin tener las señales que sabemos que habitualmente están presentes en un embrión, era única de los mamíferos. Trabajando junto a un estudiante de máster con mucho talento, Andrea Attardi, del laboratorio de Ben Steventon, empezamos a cultivar células de embriones de pez cebra muy tempranos y a dejar-las desarrollar poniéndolas juntas. ¡Y, en efecto, creaban un eje!”, dice Trivedi. “Además, si los dejas crecer suficientemente, estos agregados pueden llegar a crear una estructura que late y que, casualmente, no está en una posición al azar sino que siempre está al lado opuesto de la cola. Los llamamos Pescoides, el equivalente del gastruloide pero de pez. Mirando estos sistemas pensamos que quizás las células están intentando generar un embrión polarizado por sí mismas, aunque no tienen éxito porque les falta el ambiente instructivo y las señales requeridas de la madre”.
Cuando células embrionarias de raton o de pez cebra se sacan de su ambiente y se ponen juntas, intentan generar un embrión con polaridad.
Lo que su laboratorio quiere entender ahora es la física que hay detrás de este proceso. En particular, enfatiza dos preguntas principales: ¿cómo rompen las células la simetría de la esfera inicial? ¿Y cómo se organizan las células después para desarrollar los ejes del cuerpo?
Un punto de vista evolutivo
Si miramos los embriones de ratón y pez cebra, parecen muy diferentes en cuestión de forma y geometría en general. Sin embargo, los gastruloides y los pescoides (los organoides embriónicos ensamblados fuera de su ambiente nativo) se parecen los unos a los otros tanto al principio de su desarrollo, cuando son solo una bola de células, hasta cuando se están alargando. Esto ha llevado a Trivedi a preguntarse si lo que ve que pasa fuera del embrión es actualmente el programa de desarrollo básico, «desnudo» de cualquier influencia, que nunca podemos observar en un embrión real debido a todas las otras influencias que existen.

“Pensamos que lo que estamos observando podría ser una forma muy fundamental de desarrollo, y dependiendo de las presiones evolutivas que haya tenido cada especie, han ido construyendo en base a este programa de desarrollo inicial” explica. Si esto es correcto, la evolución habría usado este programa fundamental de desarrollo para construir los planes corporales de diferentes organismos. Por tanto, Trivedi aventura, ¿podremos entender suficientemente bien este proceso de patrón básico? ¿Y podríamos hacer que las células formen una morfología embriónica similar a la de ratón o pez, dependiendo de las condiciones en las que las pongamos?
«Pensamos que lo que estamos observando podría ser el patrón de desarrollo por defecto»
Las ventajas de los organoides
Un embrión de ratón es muy pequeño comparado con un embrión de pez o pollo. Pero utilizan las mismas redes genéticas para determinar la formación del eje. Esto se sabe desde hace tiempo. Trivedi está intentando ir más allá de los genes y la biología, a la física, observando los factores mecánicos que actúan durante la morfogénesis. Como están generando estos organoides embrionarios el laboratorio, pueden, por decirlo así, hacerlos «a la carta». Por ejemplo, en lugar de las 300 células que se utilizan normalmente, pueden crear un organoide embriónico con 30 células y uno con 3000 y mirar qué pasa, como se escala la expresión genética. Estos experimentos no se pueden hacer en un embrión. Esta es precisamente la razón para utilizar un sistema artificial; que puede ser controlado, ayudando a entender cómo se forma – y quizá también qué puede salir mal. «Los defectos del desarrollo son muy difíciles de estudiar in vivo, porque muchos mutantes son letales, explica Trivedi. El sistema artificial que está creando es prometedor y podria superar esta dificultad.
Cuando el fracaso es el éxito
Estas estructuras artificiales con las que trabaja el grupo, nunca acaban sobreviviendo (los gastruloides crecen durante 6 días, y los pescoides un día – el pez se desarrolla más rápido). Pero esto no es un problema para Trivedi; incluso al contrario. «El fracaso es importante para nosotros. De hecho, queremos que los gastruloides y los pescoides fallen en el intento de hacer embriones; así podemos entender cómo rescatarlos, ingeniando formas de hacerlo mejor y entender qué está haciendo un embrión real».
Un sistema artificial puede ser controlado y estudiado en más detalle; y si no consigue desarrollarse, podemos intentar entender porqué.
Para hacer todo este trabajo, y debido a su bagaje en ingeniería, el laboratorio que lidera Trivedi es muy interdisciplinario. Krisztina Arato se unió el año pasado como investigadora senior proveniente de otro de los centros del PRBB, el Centro de Regulación Genómica (CRG), donde hizo su doctorado. Kerim Anla es el miembro más joven y primer estudiante de doctorado del grupo. Ambos vienen con unos bagajes muy potentes en bioquímica, biología molecular e imagen. El laboratorio también tiene un fuerte interés en crear nuevas herramientas y técnicas; microscopios, procesamiento de imágenes, modelado in silico y marcaje cuantitativo y multiplex. Debido al ancho rango de metodologías que quieren utilizar e implementar, el grupo, que aún es joven, debe ser por fuerza muy multidisciplinar, y Trivedi quiere atraer a gente con diferentes bagajes que puedan entenderse entre ellos.
«Pero mi primera prioridad, en realidad, es crear un grupo muy feliz«, dice Trivedi convencido. «Si la gente está feliz, pueden pasar muchas cosas, incluso aunque requieran un poco de formación. Estoy hablando desde la experiencia; durante mi doctorado y postdoc cambié a campos desconocidos para mí y recibí mucha ayuda. Conocí científicos excelentes y gente muy amable que fueron generosos con su tiempo y energía para enseñarme y colaborar sin ser territoriales. Tener un ambiente de apoyo donde la gente están dispuesta a ayudar a la generación más joven es un privilegio; he disfrutado de este privilegio, y me gustaría que mi laboratorio fuera un lugar así», concluye.
«Me gustaría que en mi laboratorio haya un ambiente de apoyo, donde la gente está dispuesta a ayudar a las generaciones más jóvenes»