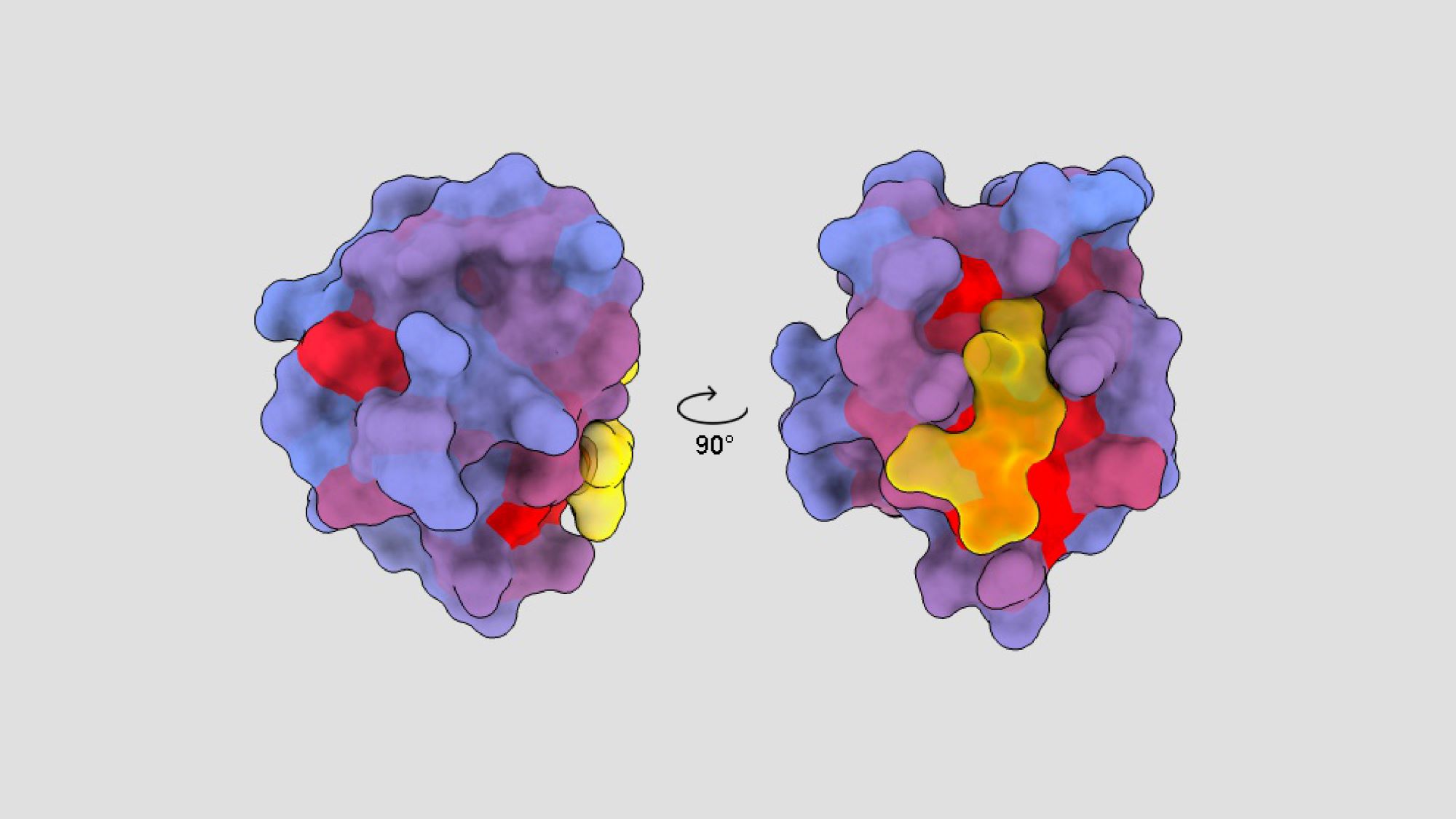
Esta imagen de André Faure, investigador post-doctoral del Centro de Regulación Genómica (CRG), muestra la estructura de una proteína humana, con sus sitios activos marcados en amarillo y los sitios alostéricos en rojo y azul, descubiertos gracias a una nueva técnica.
La mayoría de los medicamentos están desarrollados para unirse al sitio activo de la proteína diana, inhibiéndola o activándola. El problema es que estos sitios activos suelen ser muy parecidos entre distintas proteínas, con lo que el medicamento puede estar atacando a varias a la vez, lo que produce efectos secundarios y reduce la eficiencia.
Hay otros lugares en las proteínas, más escondidos pero más específicos, que al unirse a un medicamento modifican también la acción de la proteína. Estos se llaman sitios alostéricos, y son normalmente casi imposibles de detectar.
Ahora un equipo investigador del CRG ha desarrollado una nueva tecnologia que permite descubrir estos lugares alostéricos ‘escondidos’ en la estructura de la proteína. La técnica consiste en cambiar todos y cada uno de los aminoácidos de la proteína (las piezas que la forman) de uno en uno, y mirar, para cada una de las miles de versiones de la proteína resultantes, cual es el efecto cuando se introduce en células vivas en el laboratorio.
«Es un experimento de ‘fuerza bruta’ que nos permite encontrar un ‘punto flojo’ en cada proteína, un lugar donde potencialmente la podríamos atacar con un medicamento. Incluso para aquellas proteínas que hasta ahora se consideraban ‘dianas imposibles'», explica Ben Lehner, líder del grupo.
Además, según Júlia Domingo, primera co-autora del artículo, esta técnica es «más eficiente, más barata y más rápida» que otras que se usan actualmente, y podría revolucionar el desarrollo de fármacos.
Los y las investigadoras han utilizado la técnica para estudiar estos lugares o ‘puertas ocultas’ en dos de los dominios proteicos más comunes en humanos, el SH3 y el PDZ. Además, han visto que estas lugares alostéricos no tan solo pueden ser encendidos y apagados, sino modificados de formas más sutiles, como si se tratara del control de temperatura en un termostato. Esto podría ayudar a desarrollar medicamentos mucho más precisos e inteligentes.
¿Quieres ver tu foto aquí? Envíanos imágenes relacionadas con la ciencia o la vida en el PRBB a ellipse@prbb.org.
Faure, A.J., Domingo, J., Schmiedel, J.M. et al. Mapping the energetic and allosteric landscapes of protein binding domains. Nature 604, 175–183 (2022). https://doi.org/10.1038/s41586-022-04586-4