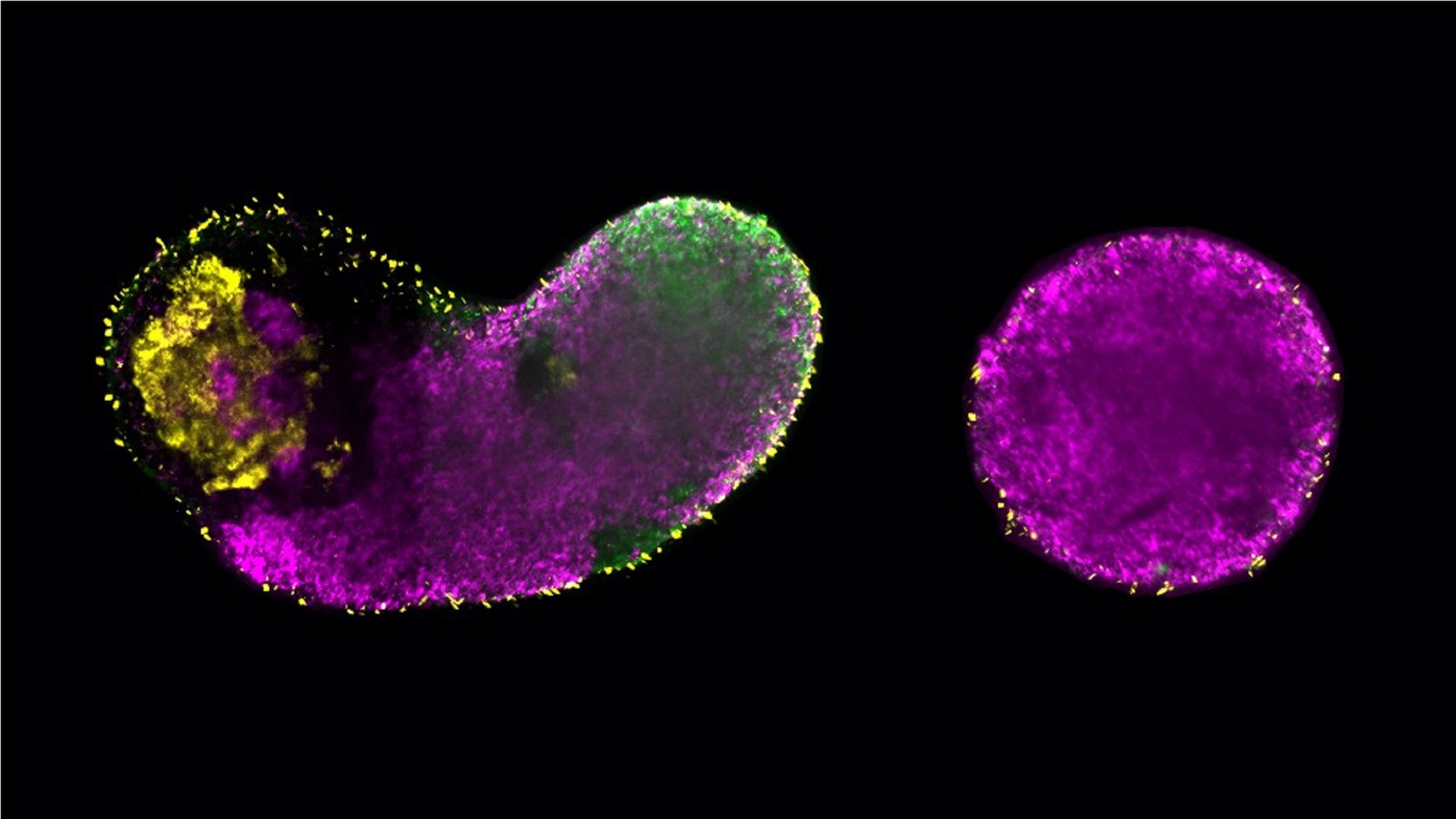
Siempre se ha pensado en la glucólisis como el proceso básico de producción de energía en las células: el metabolismo básico que convierte los azúcares en energía. Ahora, equipos investigadores del Laboratorio Europeo de Biología Molecular de Barcelona (EMBL Barcelona) y del Instituto Max Planck CBG de Dresde han descubierto de forma independiente que desempeña un papel mucho más activo en el desarrollo embrionario de lo que se pensaba.
Los científicos del EMBL Barcelona, en concreto del laboratorio de Vikas Trivedi, demostraron que la glucólisis no sólo impulsa el crecimiento celular, sino que también influye directamente en las decisiones tempranas sobre el destino de las células al regular vías de señalización cruciales como Wnt, Nodal y Fgf. Utilizando modelos embrionarios basados en células madre (generados a partir de células madre embrionarias humanas y de ratón), demostraron que la manipulación de la glucólisis influye en el desarrollo de las células hacia el mesodermo y el endodermo (tipos de tejido clave para los músculos, la sangre y los órganos) o hacia el ectodermo (el futuro sistema nervioso). Curiosamente, con la glucólisis bloqueada, el refuerzo artificial de las vías de señalización podía restaurar el desarrollo normal, pero no la glucólisis, lo que revela el doble papel de la glucólisis: metabólico e instructivo.
“Los resultados ponen de relieve el papel crucial del metabolismo como regulador de vías de señalización específicas que influyen en las decisiones celulares”
Kristina Stapornwongkul, (EMBL Barcelona. IMBA)
Lo interesante es que estas dos funciones están desacopladas, dice Kristina Stapornwongkul, una investigadora del laboratorio de Trivedi que justo empieza su propio grupo de investigación en el IMBA de Viena (Austria). «Desde el punto de vista evolutivo, esto es apasionante porque el metabolismo es anterior a la señalización», añade Trivedi. «Incluso los organismos unicelulares dependen del metabolismo, mientras que la señalización surgió más tarde en la evolución. Esto ha despertado mi curiosidad sobre el papel del metabolismo en el origen de la multicelularidad».
“Este estudio marca el comienzo de una nueva y emocionante dirección para mi grupo”
Vikas Trivedi (EMBL Barcelona)
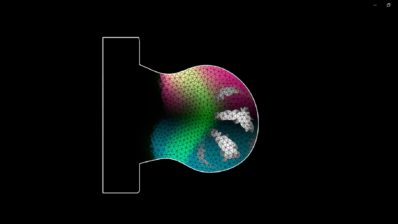
El equipo de Dresde, dirigido por Jesse Veenvliet, utilizó inteligencia artificial para llegar a conclusiones similares sobre el papel de la glucólisis en la dirección de las decisiones de desarrollo en el embrión.
Empezaron abordando la variabilidad existente en las estructuras parecidas a troncos, un modelo basado en células madre del desarrollo embrionario del tronco. Incluso en condiciones idénticas, algunos modelos se parecían más a los embriones naturales que otros. Los investigadores descubrieron que una preferencia metabólica temprana por la glucólisis frente a la fosforilación oxidativa (otra de las formas que tiene la célula de crear energía), predice mejores resultados de desarrollo.
Mediante el aprendizaje automático y las imágenes, identificaron marcadores metabólicos tempranos que pronostican el éxito del desarrollo. También demostraron que potenciar la glucólisis con fármacos mejora la consistencia y calidad de estos modelos. Estos hallazgos abren nuevas posibilidades para crear modelos basados en células madre más reproducibles, cruciales para el modelado de enfermedades, el ensayo de fármacos y el estudio de la biología del desarrollo, al tiempo que se minimiza el uso de animales.
En conjunto, estos estudios marcan un cambio en la forma en que los científicos y científicas entienden la relación entre metabolismo y desarrollo. En lugar de ser un proceso secundario, el metabolismo – y en particular la glucólisis – dirige activamente la formación de las estructuras corporales desde los primeros pasos de la vida.
Referencias: Barcelona study: Glycolytic activity instructs germ layer proportions through regulation of Nodal and Wnt signaling, Cell Stem Cell (2025). Stapornwongkul K. et al. Cell Stem Cell 16/04/2025
Desden study: Integrated molecular-phenotypic profiling reveals metabolic control of morphological variation in a stem-cell-based embryo model, Villaronga-Luque A., Savill R. G., et al. Cell Stem Cell 16/04/2025. https://doi.org/10.1016/j.stem.2025.03.012