A la hora de recetar un medicamento no suele tenerse en cuenta la información genética del paciente. Pero, por ejemplo, una deficiencia en el gen G6PD puede provocar fatiga o dolores abdominales a quien tome una simple aspirina.
Por eso, la farmacogenómica – el estudio de los efectos de los medicamentos según la genética de los individuos – es actualmente un campo emergente. Podría abrir las puertas hacia una medicina personalizada en la que, en el futuro, podrían realizarse pruebas genéticas sencillas combinadas con inteligencia artificial (IA) para identificar pacientes vulnerables, o adjuntar nuestro perfil farmacogenético a nuestro historial clínico.
Ahora, una investigación internacional liderada por el Instituto de Biología Evolutiva (IBE: CSIC-UPF) ha desarrollado uno de los estudios más amplios sobre la influencia de la variación genética de los individuos en la toxicidad que provocan ciertos medicamentos. Este estudio ha utilizado bases de datos públicas, de los proyectos 1000 genomes (1000G), Simmons Genome Diversity Project (SGDP) y Human Genome Diversity Project (HGDP), para analizar datos genéticos de 3.714 personas de diferentes ascendencias de los cinco continentes, centrándose en el impacto de 1.136 variantes genéticas asociadas con la toxicidad de ciertos grupos de fármacos. Mediante el uso de técnicas de inteligencia artificial, el equipo ha podido establecer patrones de riesgo de toxicidad que podrían ser de gran utilidad en el camino hacia una medicina más personalizada.
“El que observemos diferencias entre poblaciones para estas variantes sugiere que sería interesante incluir la ascendencia genética del individuo al hacer estudios de toxicidad, para llegar a tener tratamientos más personalizados”
Òscar Lao, investigador principal del estudio
Los resultados revelan que las poblaciones de ascendencia americana y europea presentan un mayor riesgo de toxicidad en un amplio abanico de fármacos. En particular, se ha detectado una mayor susceptibilidad a fármacos cardiovasculares y antimicrobianos en estas poblaciones. Además, las poblaciones americanas muestran un alto riesgo con antidepresivos y analgésicos, mientras que las europeas son más vulnerables a los inmunosupresores y a los fármacos anticancerígenos. En el otro extremo, las poblaciones de ascendencia del este asiático y, en menor medida, las de ascendencia oceánica, presentan un riesgo muy bajo de toxicidad en general, con la excepción de algunas poblaciones de Asia central que muestran sensibilidad a los analgésicos. Las poblaciones africanas se encuentran en una situación intermedia, con mayor variedad.
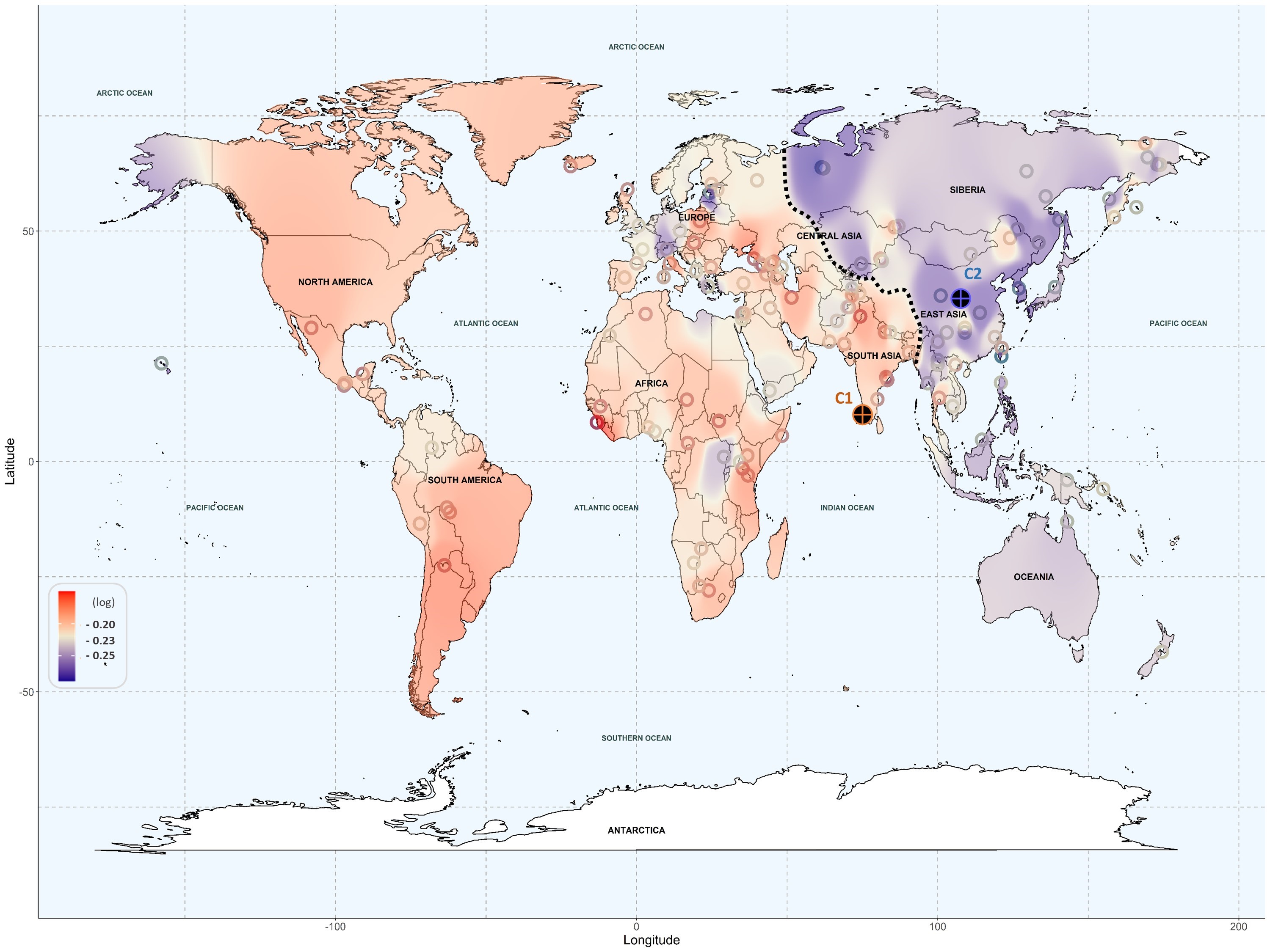
Para llevar a cabo el análisis genómico, los investigadores han utilizado técnicas de aprendizaje automático (machine learning) para estudiar la función de genes implicados en la absorción y el transporte de fármacos. Además, la minería de textos (text mining), que se basa en la obtención de información a partir de datos en texto, ha permitido extraer y agrupar variantes genéticas, relacionándolas con ascendencias genéticas de regiones geográficas concretas. Estas técnicas han revelado patrones de riesgo genético que pueden tener un gran impacto en la medicina personalizada.
“En última instancia, sin embargo, el riesgo de sufrir efectos adversos es específico de cada individuo, más allá de su ascendencia. Idealmente, deberían secuenciarnos todo el genoma para poder establecer nuestros patrones de riesgo”, advierte Òscar Lao, investigador principal del estudio.
Karamperis, K., Katz, S., Melograna, F., Ganau, F. P., Van Steen, K., Patrinos, G. P., Lao, O. (2024). Genetic ancestry in population pharmacogenomics unravels distinct geographical patterns related to drug toxicity, iScience, 27(10). DOI:10.1016/j.isci.2024.110916