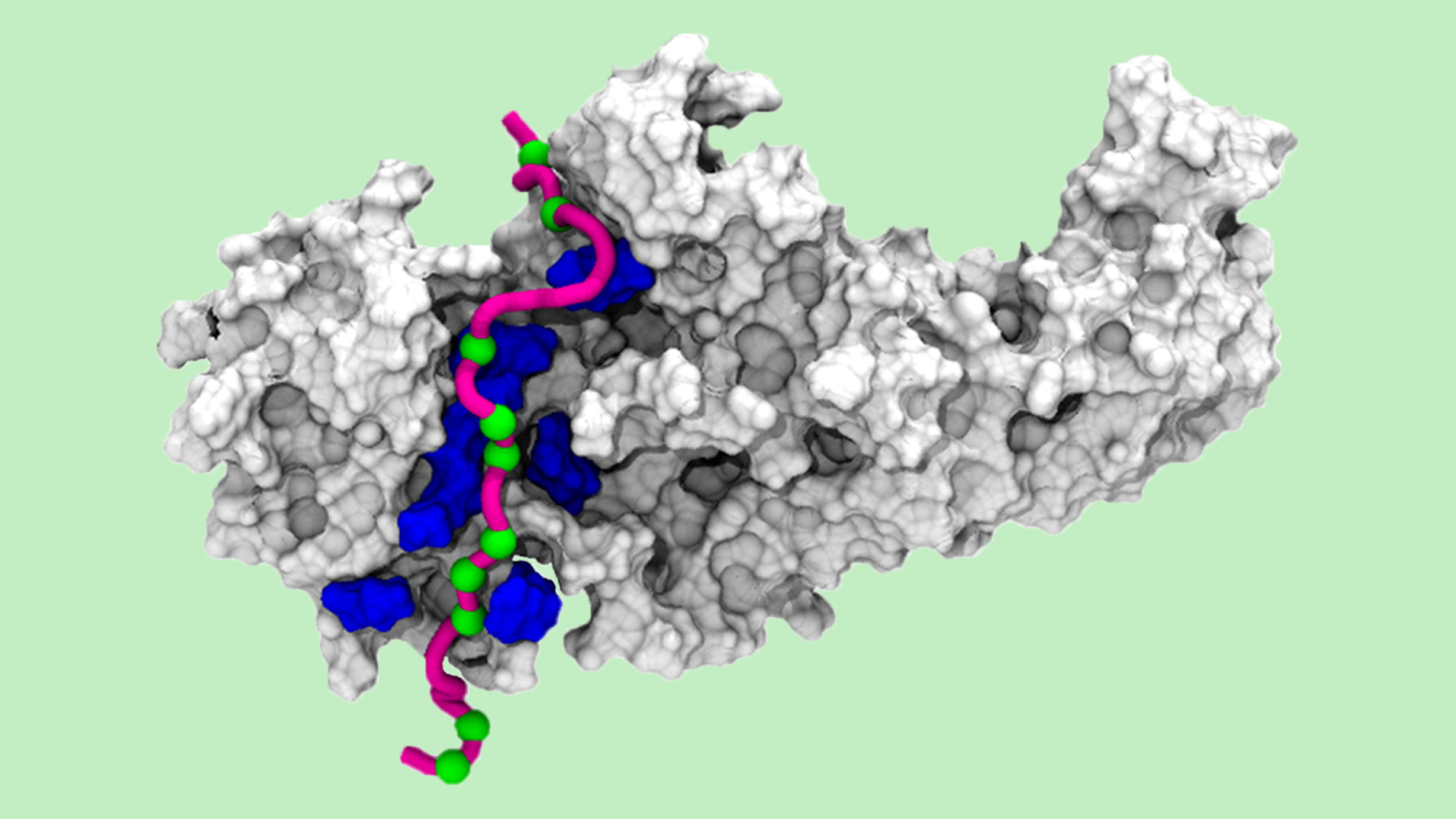
El grupo de Desarrollo de fármacos en base a GPCR del Instituto de Investigaciones Médicas del Hospital del Mar (IMIM), liderado por Jana Selent, nos ha enviado esta imagen creada mediante simulaciones computacionales a gran escala, que muestra una molécula de arrestina en 3D ‘leyendo’ un patrón de fosforilación específico.
Este es el resultado de un estudio realizado en colaboración con el Instituto Indio de Tecnología en Kanpur. Las investigadoras han descifrado la forma en que las β-arrestinas cambian su estructura tridimensional en respuesta a diferentes patrones de fosforilación, lo que a su vez modula la principal cascada de señalización intracelular.
«Hemos descubierto el mecanismo molecular subyacente de cómo la arrestina lee y traduce un patrón de fosforilación específico en una respuesta celular»
Jana Selent
(investigadora principal en el IMIM)
La respuesta de una célula a los estímulos externos está a menudo mediada por un tipo de proteínas unidas a la membrana llamadas receptores acoplados a proteína G (GPCR). El proceso de señalización desencadenado por la célula cuando se estimula es el siguiente:
- Un estímulo extracelular (olor, sabor, hormona, luz, una droga…) llega a la célula.
- Esto conduce a la fosforilación de la cola de los GPCR. Dependiendo del estímulo, el patrón de fosforilación varía, alterando la respuesta celular.
- Las β-arrestinas se unen a la cola de los GPCR y leen el patrón de fosforilación. Como el grupo de investigación ha descifrado, diferentes códigos de fosforilación inducen distintas rotaciones en las estructuras 3D de las arrestinas.
- De acuerdo con sus estructuras 3D, las arrestinas modulan las quinasas intracelulares, que determinan el comportamiento de la célula al conducir a la expresión génica, la supervivencia celular o la muerte celular.
En la imagen, los sitios fosforilados de la cola rosa de GPCR (vistos como esferas verdes) son leídos por sensores específicos en la molécula de arrestina (áreas azules en la imagen). Esta información se traduce en una conformación de arrestina específica que desencadena más eventos de señalización.
«Nuestros hallazgos moleculares crean nuevas oportunidades para replantear los enfoques de tratamiento actuales y diseñar estrategias terapéuticas novedosas para enfermedades importantes como el cáncer o el Alzheimer«, dice Tomasz Stepniewski, coautor del estudio.
¿Quieres ver tu foto aquí? Envía tus imágenes relacionadas con la ciencia o la vida en el PRBB a ellipse@prbb.
Dwivedi-Agnihotri et al. “Distinct phosphorylation sites in a prototypical GPCR differently orchestrate β-arrestin interaction, trafficking, and signaling“ Science Advances 11 Sep 2020 : EABB8368.