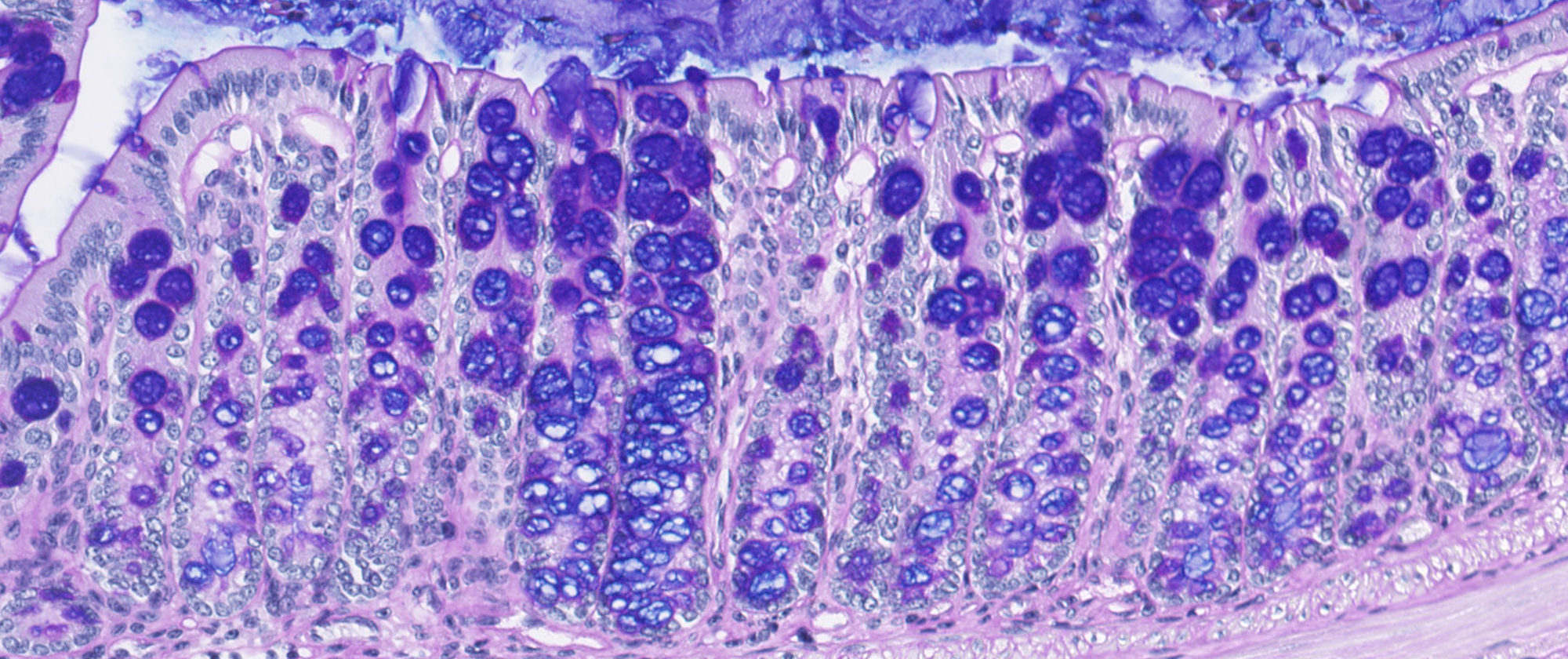
Quan estem encostipats, el nostre cos sembla capaç de produir una quantitat inacabable de moc. Investigadors del Centre de Regulació Genòmica (CRG) en col·laboració amb científics del Departament de Ciències Experimentals i de la Salut, Universitat Pompeu Fabra (DCEXS-UPF), han descobert el mecanisme pel qual les cèl·lules controlen quanta mucina – el principal macrocomponent del moc – produeixen en funció de les seves necessitats. Així, les cèl·lules caliciformes, les cèl·lules secretores de mucositat que es troben a l’epiteli de les mucoses del sistema digestiu i les vies respiratòries, poden produir grans quantitats de moc quan hi ha presència d’al·lèrgens o patògens o bé alliberar-ne la mida justa i de forma constant només per preservar la capa mucosa.
“Hi ha dos tipus de secreció de mucina; la basal, per mantenir la capa de moc estable, i la estimulada – per al·lèrgens o patògens – on es necessita una gran secreció de cop i volta per a protegir l’epiteli. Se sabia que aquesta secreció està controlada per calci, però no se sabia d’on venia el calci”, explica Gerard Cantero-Recasens, investigador post doctoral al laboratori de Vivek Malhotra al CRG i primer autor dels dos articles d’aquest estudi.
El mecanisme de control que els científics han descobert es basa en un sistema doble de sensors de Calci:
- Dues proteïnes, el canal iònic TRPM4 i la NCX, que es troben a la superfície de les cèl·lules i que treballen plegades per controlar l’entrada de calci a la cèl·lula.
- Un sensor de calci dins la cèl·lula, la proteïna KChIP3, que controla la secreció basal de mucines per mantenir una capa òptima a les mucoses i protegir-les. Aquest sensor actua frenant l’alliberament excessiu de mucines, perquè en condicions normals s’uneix a les vesícules secretores de mucines, impedint-ne la seva secreció. En resposta a pics regulars de Calci intern, la KChIP3 va alliberant d’una en una les vesícules secretores. Però quan TRPM4 i NCX deixen entrar molt de Calci a la cèl·lula, el sensor intern KChIP3 s’uneix al Calci, deixant lliures moltes de les vesícules de cop, que aleshores poden secretar el moc. De fet, en un experiment amb ratolins sense el sensor KChIP3, aquests tenien una capa més densa de mucosa al còlon.
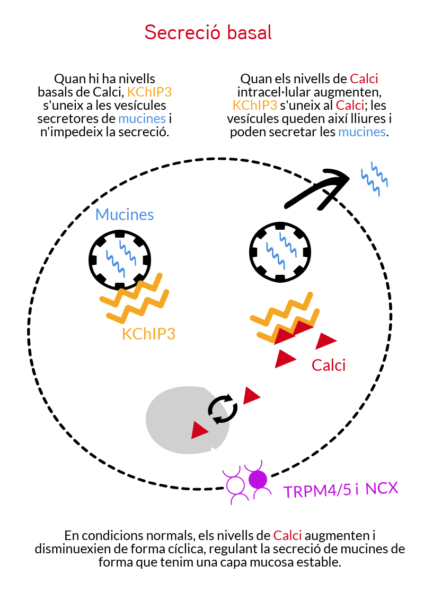
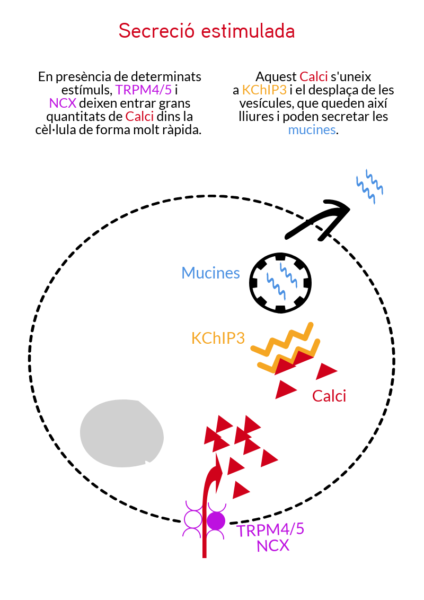
Hi ha dos tipus de secreció de mucina; la basal, per mantenir la capa de moc que recobreix els nostres epitelis, i la estimulada, deguda a la presència d’al·lèrgens o patògens, que fa que se secreti molta mucina de cop i volta per a protegir l’epiteli.
Un estudi col·laboratiu de llarga durada
“L’estudi va començar cap al 2013 amb un cribratge genòmic on vam identificar 25 proteïnes implicades en la secreció de mucines en cèl·lules de càncer de còlon,” explica Cantero-Recasens.
Després de seleccionar tres d’aquestes proteïnes, les han estudiat en cultius cel·lulars derivats de vies respiratòries sanes, de colon sa, i de colon amb fibrosi quística. “Hem col·laborat molt amb el laboratori de Miguel Valverde aquí al DCEXS-UPF; hem utilitzat els seus microscopis ja que tenen un sistema per mesurar el Calci intracel·lular”, diu Cantero-Recasens.

Estudiant les diferents línies cel·lulars, l’equip va descobrir que el procés de control de la secreció de mucines – a través de TRPM4 i NCX – és el mateix en les vies respiratòries i en el colon.
El grup està col·laborant ara amb investigadors de l’Hospital Del Mar i l’Institut Hospital del Mar d’Investigacions Mèdiques (IMIM) per identificar si pacients amb malalties en vies respiratòries i còlon tenen alguna mutació genètica en les mucines o les proteïnes implicades en la seva secreció.
També estan treballant per trobar molècules químiques que puguin controlar aquestes vies de secreció de mucines.
Totes dues aproximacions, la genètica i la química, poden esdevenir noves vies per detectar i controlar la progressió de malalties on es produeix massa o massa poc moc, com ara l’asma, la malaltia pulmonar obstructiva crònica (MPOC), la malaltia de Crohn o el càncer colorectal.
En aquest vídeo, el primer autor dels articles, Gerard Cantero-Recasens, ens explica en primera persona com han fet aquest estudi.
Cantero-Recasens, G., Butnaru, C. M., Valverde, M. A., Naranjo, J. R., Brouwers, N., and Malhotra, V. (2018) KChIP3 coupled to Ca2+ oscillations exerts a tonic brake on baseline mucin release in the colon. Elife. 10.7554/eLife.39729
Cantero-Recasens, G., Butnaru, C. M., Brouwers, N., Mitrovic, S., Valverde, M. A., and Malhotra, V. (2018) Sodium channel TRPM4 and sodium/calcium exchangers (NCX) cooperate in the control of Ca2+-induced mucin secretion from goblet cells. J. Biol. Chem.10.1074/jbc.RA117.000848