En marzo arrancó el proyecto europeo ‘SkinDev’, coordinado por Marc Güell del Departamento de Medicina y Ciencias de la Vida (MELIS). Su objetivo es utilizar biología sintética para modificar el microbioma de la piel que puedan, en un futuro, servir como plataforma para desarrollar terapias o herramientas diagnósticas. Inicialmente se enfocarán en la dermatitis atópica, una irritación crónica de la piel caracterizada por sequedad y formación de eccemas.
El proyecto ha recibido tres millones de euros por parte del Consejo Europeo de la Innovación, un organismo que busca identificar, desarrollar y ampliar tecnologías de vanguardia e innovaciones revolucionarias. Además de la UPF, cuenta con la participación de equipos de Inglaterra, Holanda y Alemania, todos ellos liderados por jóvenes investigadores e investigadoras.
Hablamos con Javier Santos, investigador postdoctoral en el laboratorio liderado por Marc Güell en la UPF y participante en el proyecto.

¿Por qué os planteáis este proyecto?
Los tratamientos actuales para tratar la dermatitis, mayoritariamente cremas con corticoides, tienen efectos secundarios, y requieren de una aplicación constante. Nuestra propuesta es modificar una de las bacterias naturales de la piel para que detecte cuando hay irritación y libere antiinflamatorios directamente.
El objetivo del proyecto es modificar una bacteria natural de la piel para que detecte cuando hay irritación y libere antiinflamatorios localmente
Para ello proponemos usar Cutibacterium acnes, una bacteria que en condiciones normales evita que otros patógenos nos infecten. Ésta tiene varias ventajas:
1- es la bacteria más abundante de la piel, por tanto nuestra piel está acostumbrada a tenerla en grandes cantidades.
2- se encuentra sobre todo en los folículos, es decir no en la parte más superficial de la piel, sinó un poco más profunda, con lo que no se va tan fácilmente, por ejemplo al lavarnos, sino que se queda más tiempo en la piel.
De hecho, un estudio previo de nuestro laboratorio mostró que las bacterias aisladas de una persona donante podían aplicarse en una persona receptora y permanecer allí durante varias semanas. Después desaparecían por sí mismas, lo que también es una ventaja.
¿Y cómo se ponen estas bacterias en la piel?
Después de hacer las modificaciones necesarias para que las bacterias sean capaces de detectar inflamación de forma local y, en respuesta, liberar la molécula antiinflamatoria que le hayamos añadido, se hacen crecer y se resuspenden en una solución. El producto final es un preparado (un líquido, o emulsión) con las bacterias en suspensión. La idea es entonces poner unas gotas en la piel, como si te pusieras colonia o una crema, y las bacterias solas entran en los folículos.
Las bacterias producirían y liberarían de forma local una molécula antiinflamatoria durante las 2-3 semanas que las bacterias duren en la piel. Si al cabo de ese tiempo todavía necesitas tratamiento, se podría volver a poner. Incluso podría pensarse en poner la bacteria cada cierto tiempo, como forma preventiva (no solo cuando vemos la inflamación), y que la bacteria detectara cuándo la piel se está inflamando y frenara el proceso desde el principio; y si no hay inflamación, pues entonces la bacteria no haría nada.
Hay muchas posibilidades… Pero hasta ahora casi nadie había podido modificar a C. acnes, controlar su comportamiento. Y esto es obviamente el primer paso.
¿Y lo habéis conseguido?
Para empezar era difícil conseguir que entrara ADN externo, porque tiene varios mecanismos para evitarlo, como enzimas de restricción, o CRISPR. Nosotros ahora hemos conseguido crear ADN que escapa a este ataque de la bacteria.
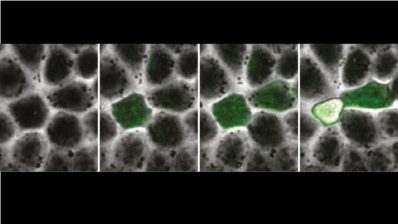
El siguiente obstáculo era tener herramientas moleculares para modificar esta bacteria en concreto – las herramientas que ya existen para otras bacterias, como GFP (la proteína fluorescente que sirve para saber si un gen se está expresando o no) no se habían probado con C. acnes. Y también hemos hecho progresos en esto, estamos desarrollando una especie de ‘caja de herramientas’ para poder modificar este tipo de bacteria.
¿Cuánto hace que estáis trabajando con esta bacteria?
El laboratorio lleva unos 5-6 años con este tema, aunque el último año es cuando hemos avanzado más. Hay que tener en cuenta que la ciencia no es lineal, a veces lleva mucho tiempo superar un obstáculo, y luego quizás se avanza de golpe. Otra desventaja es que esta bacteria crece relativamente lenta; así como E. coli en un día ha crecido, con C. acnes se necesita una semana.
Pero estos últimos avances, con los que hemos demostrado que sí se puede modificar la bacteria, son los que nos han permitido conseguir financiación para este proyecto europeo.
¿Y cómo está organizado el proyecto?
Tiene tres ejes principales, que llevarán a cabo los diferentes colaboradores:
- Desarrollar herramientas para que la bacteria pueda detectar inflamación en casos de dermatitis atópica y combatirla. Esta parte es la que hacemos sobretodo desde nuestro laboratorio, y con Rodrigo Ledesma del Imperial College de Londres.
- Crear modelos matemáticos de dermatitis atópica que ayuden en el desarrollo de las bacterias, definiendo qué cantidad de moléculas se necesitan, identificando cuáles son los biomarcadores de inflamación más prometedores, o prediciendo cómo interaccionan nuestras cepas modificadas con la piel y con la microbiota natural de la piel, por ejemplo. Para esto contamos con el equipo liderado por Reiko Tanaka, también desde el Imperial.
- Desarrollar cultivos celulares en 3D (una especie de ‘organoide’ de piel) para testar las nuevas cepas de C. acnes creadas. Esta parte está a cargo de Ellen Van den Bogaard de la Universidad Radboud Medical Center de Holanda y Bernhardt Homey, de la Universidad de Düsseldorf.
¿Entonces las pruebas funcionales las haréis in vitro?
Existen modelos de dermatitis de ratón, pero no sé hasta qué punto serían extrapolables nuestros resultados, porque los ratones no tienen C. acnes de forma natural. Por eso de momento vamos a testar la funcionalidad en células humanas en cultivo 3D, que serían lo más parecido.
En cualquier caso el último paso sería un ensayo clínico en humanos; pero tal como estamos haciendo el proyecto ahora no se podría, porque usamos resistencia a antibióticos para seleccionar las bacterias que queremos, etc. Esto va bien para avanzar rápido, pero para su uso clínico habría que usar otra cosa, y ya estamos trabajando en ello. De todos modos hoy en día es difícil en Europa que aprueben un ensayo con bacterias modificadas… genera un poco de recelo. En EEUU sí que existen ya algunos ensayos clínicos con este tipo de bacterias, pero en Europa el control es más restrictivo.
Si esto funciona ¿estas bacterias se podrían modificar también para tratar otras enfermedades o condiciones?
Si, ahora mismo Nastassia Knödlseder de nuestro laboratorio ya está trabajando en temas de acné y caída de cabello.