Las condiciones en las que un individuo ingresa en la Unidad de Curas Intensivas (UCI) de un hospital son críticas. El paciente suele encontrarse en tal estado que es incapaz de respirar por sí mismo. Si queremos salvar su vida, es indispensable que sea sometido a ventilación mecánica. No obstante, su uso, limitado a mantener con vida al individuo crítico, no está libre de riesgos.
Recientemente, un estudio dirigido por médicos del Hospital del Mar e investigadores del Instituto Hospital del Mar de Investigaciones Médicas (IMIM) ha destacado que promover estrategias de ventilación mecánica que permitan trabajar la musculatura respiratoria de los pacientes ingresados en la UCI disminuye el daño que sufren y podría facilitar su recuperación.
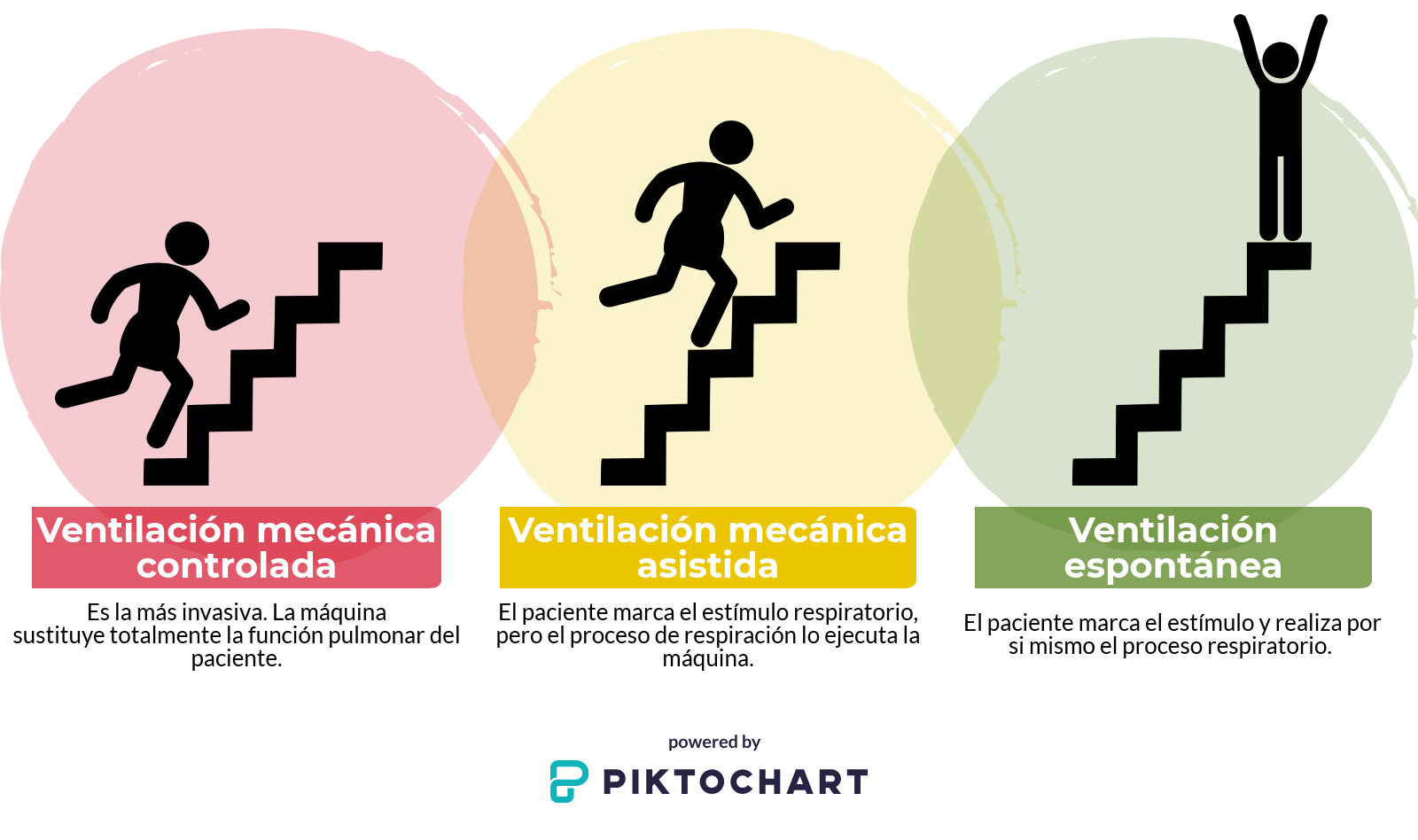
Existen tres tipos diferentes de ventilación mecánica:
- Ventilación mecánica controlada: es la más invasiva. La máquina sustituye totalmente la función respiratoria del paciente.
- Ventilación mecánica asistida: el paciente marca el estímulo respiratorio, pero el proceso respiratorio lo ejecuta la máquina.
- Ventilación espontánea: el paciente marca el estímulo y realiza por si solo el proceso respiratorio.
Los médicos de las Unidades de Curas Intensivas (UCI) de los hospitales siempre intentarán retirar la ventilación artificial lo antes posible. El objetivo de la retirada es que acabe siendo el propio paciente el que vuelva a respirar por si mismo y evitar algunos de los problemas que puedan surgir a partir de la ventilación mecánica.
La Dra. Judith Marín, primera autora del artículo, nos explica en esta entrevista cómo ella y su equipo han llegado hasta aquí y hacia donde se enfocará su investigación a partir de ahora.

¿Por qué es importante estudiar la disfunción muscular en pacientes críticos?
Durante muchos años, el objetivo prioritario de los médicos intensivistas ha sido salvar la vida de los pacientes. Esto nos llevaba a ser muy invasivos en el ingreso de los pacientes, descuidando aspectos tan importantes como la disfunción muscular que sufren tras una estancia en la UCI. A día de hoy sabemos que es esta disfunción muscular lo que condiciona una peor calidad de vida una vez sobreviven.
Es por eso que el estudio de este campo es importante, al igual que la implementación de las herramientas de las que disponemos para evaluar y tratar la disfunción muscular para poder evitar al máximo que ésta condicione el día a día del individuo una vez se reincorpore de nuevo a su vida.
¿Qué se entiende por ventilación mecánica?
Cuando un paciente sufre una insuficiencia respiratoria grave o se encuentra en un nivel de conciencia que no le permite respirar por si mismo, hemos de poner a su alcance dispositivos que suplan la función respiratoria. Estos dispositivos pueden ser no invasivos o invasivos. Nuestro estudio se ha enfocado en la ventilación mecánica invasiva.
En el caso de la ventilación mecánica, los pacientes están intubados y conectados a una máquina. Según como hagamos funcionar la máquina, hablaremos de ventilación mecánica controlada, asistida o espontánea.
Según la modalidad de ventilación mecánica que se use, se estará induciendo un grado de disfunción diferente en el paciente. La ventilación mecánica controlada sería la modalidad más perjudicial.
¿Cuál es el descubrimiento de vuestro estudio respecto a los tipos de ventilaciones mecánicas?
Se trata del primer estudio en humanos que demuestra que, según la modalidad que se use en el momento de asistir la respiración de los pacientes, estaremos induciendo un grado de disfunción diferente. Cuanto más dejemos trabajar la musculatura respiratoria del paciente, mejor.
En esta línea, hemos visto que la modalidad más perjudicial es la ventilación mecánica controlada y que, por tanto, la deberíamos evitar al máximo. Si dejamos trabajar la musculatura respiratoria de los pacientes lo antes posible, acortaremos el periodo de ventilación mecánica y, consecuentemente, los días de ingreso en la UCI.
¿Cómo habéis demostrado que la ventilación mecánica controlada es la más perjudicial?
En la literatura, los estudios que encontramos que relacionan el daño de la musculatura respiratoria con los mecanismos de ventilación mecánica se han llevado a cabo a partir de muestras de donantes de órganos. No se suelen usar biopsias de diafragma de pacientes ingresados en la UCI y sometidos a ventilación mecánica ya que, debido al estado crítico de estos individuos, el procedimiento es complicado y poco recomendado.
La novedad de nuestro estudio es la incorporación de un nuevo tipo de donante: el Maastricht III. Hasta el momento, solo se estudiaban donantes por muerte encefálica, es decir, donantes que habían sufrido un daño severo a nivel del Sistema Nervioso Central y que, por tanto, no podían ejercitar su diafragma. Este tipo de donante es sometido a ventilación mecánica controlada.
Los donantes en asistolia controlada tipo Maastricht III también han sufrido daños a nivel del Sistema Nervioso Central pero, a diferencia de los primeros, no han llegado a muerte encefálica, de modo que permanecen en coma o estado vegetativo. Estos individuos sí pueden tener estímulos respiratorios y, por tanto, ejercitar su diafragma. Así pues, los Maastricht III pueden estar sometidos a ventilación mecánica asistida.
En el estudio se ha demostrado que, a partir de las 100 horas de estar sometidos a ventilación mecánica sin trabajar la musculatura respiratoria, los donantes empiezan a presentar signos de atrofia y daño muscular. No obstante, se sabe que menos horas ya son perjudiciales.
Después de analizar la musculatura respiratoria de ambos tipos de donantes hemos visto como, en comparación con los Maastricht III, los pacientes por muerte encefálica presentaban unas fibras musculares más pequeñas y con signos de afectación a nivel histológico.
Ya que la obtención de biopsias en pacientes críticos es complicada, ¿se puede analizar el diafragma de estos individuos de otra manera?
Sí, mediante ecografías diafragmáticas de los pacientes. Estamos viendo cómo el grosor de las fibras musculares que observamos mediante ecografía se correlaciona muy bien con lo que observamos en los estudios histológicos de las muestras de donantes.
Queremos incorporar la realización de estas ecografías de manera sistemática para ver cómo va atrofiándose el diafragma. Este será el trabajo que nos permita acabar de demostrar que, cuanto más cortos sean los periodos de ventilación mecánica controlada, más cortos serán los tiempos de recuperación.
¿De cuanto tiempo estamos hablando a la hora de ganar tiempo en la recuperación?
Esto depende mucho del paciente. Se tiene que individualizar mucho. Lo que sí se ha visto es que, si un paciente demuestra tolerancia a la ventilación espontánea, es necesario hacer el cambio de ventilación mecánica controlada a espontánea lo antes posible ya que, en estudios en animales, se ha demostrado que la disfunción diafragmática asociada a la ventilación mecánica se da en 6-12 h.
La disfunción del diafragma aparece en tan solo unas horas de estar sometidos a la ventilación mecánica.
A partir de ahora, y gracias a la evidencia aportada, ¿crees que reduciréis la cantidad de pacientes sometidos a ventilación mecánica controlada?
Lo que podemos reducir no es tanto la cantidad de pacientes que necesitan ventilación mecánica controlada, sino el tiempo que están sometidos estos pacientes a este tipo de ventilación. Necesitamos protocolizar muchos procesos, entre ellos el de sedación, porque muchas veces vemos que el tiempo de ventilación mecánica controlada que requiere la patología se alarga por ejemplo por un exceso de sedación. Muchas veces vemos que el tiempo de ventilación mecánica controlada que requiere la patología se alarga por otros factores, como el exceso de sedación. Es por eso que se deben establecer nuevos protocolos. Cada vez tenemos más herramientas y fármacos que nos permiten tener a pacientes despiertos y tranquilos tolerando mecanismos de ventilación mecánica. Se debe trabajar en la movilización precoz de estos individuos y mejorar su estado nutricional. Todo esto son estrategias que nos ayudan a hacer que los músculos trabajen.